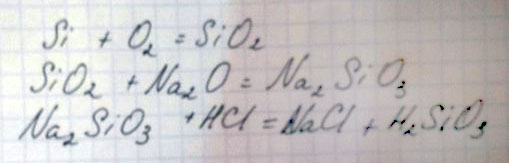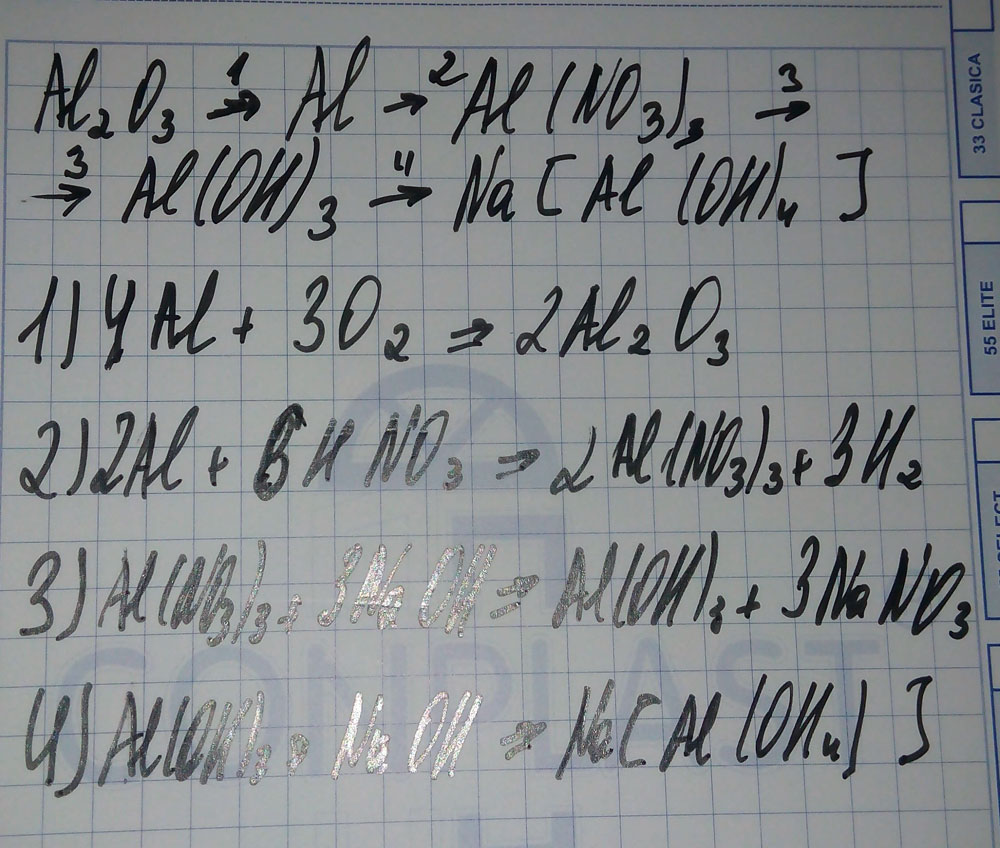Осуществите превращение - задачи и примеры
Осуществить превращение:
1) Si→ SiO2→ Na2SiO3→ H2SiO3
2) Al(OH)3→ Al(NO3)3→ Al2O3→ AlCl3
1) Si→SiO2→Na2SiO3→H2SiO3
Si + O2 + t = SiO2
SiO2 + 2NaOH + t = Na2SiO3 + H2O
Na2SiO3 + CO2 + H2O = Na2CO3 + H2SiO3
2) Al(OH)3→Al(NO3)3→Al2O3→AlCl3
Al(OH)3 + 3HNO3 = Al(NO3)3 + 3H2O
4Al(NO3)3 + t = 2Al2O3 + 12NO2 + 3O2
Al2O3 + 6HCl = 2AlCl3 + 3H2O
Осуществите превращение:
1) Si→ SiO2→ Na2SiO3→ H2SiO3
2) Al(OH)3→ Al(NO3)3→ Al2O3→ AlCl3
1) задание.
1 реакция:
Si+O2 = SiO2 - р. Соединения.
2 реакция:
2SiO2+2NaOH = 2Na2(SiO3)+H2 - р. Замещения
3 реакция:
Na2SiO3+H2O = H2SiO3+Na2O - р. Замещения
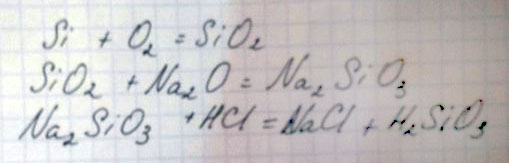
Осуществить превращение, записав уравнение хим. реакции самостоятельно, укажите тип реакций и название полученных веществ:
Na-Na2O-NaOH-Na2SO4-BaSO4
Тире это стрелки
Na+O2-Na2O2 Na2O2+Na-Na2O Na2O+H2O-NaOH NaOH+H2SO4-Na2SO4+H2O Na2SO4+BaCl-BaSO4+NaCl
Осуществите превращение: HCl-Cl2-MgCl2-HCl-CaCl2
H2 + Cl2 = 2HCl H2(0) -2e = 2H(+1)|1 восстановитель Cl2(0) +2e = 2Cl(-1)|1 окислитель.
2HCl + Mg = MgCl2 + H2 Mg(0) -2e = Mg(2+)|1восстановитель 2H(+1) +2e = H2(0)|1 окислитель.
MgCl2 + Ca(OH)2 = Mg(OH)2 + CaCl2 Mg(2+) +2Cl(-) + Ca(2+) +2OH(-)= Mg(OH)2 + Ca(2+) + 2Cl(-)
Mg(2+) + 2OH(-) = Mg(OH)2
H2 + Cl2 = 2HCl H2(0) -2e = 2H(+1)|1 восстановитель Cl2(0) +2e = 2Cl(-1)|1 окислитель.
2HCl + Mg = MgCl2 + H2 Mg(0) -2e = Mg(2+)|1восстановитель 2H(+1) +2e = H2(0)|1 окислитель.
MgCl2 + Ca(OH)2 = Mg(OH)2 + CaCl2 Mg(2+) +2Cl(-) + Ca(2+) +2OH(-)= Mg(OH)2 + Ca(2+) + 2Cl(-)
Mg(2+) + 2OH(-) = Mg(OH)2
Осуществить превращение:
оксид алюминия- алюминий- нитрат алюминия- гидроксид алюминия- тетрагидроксоалюминат натрия
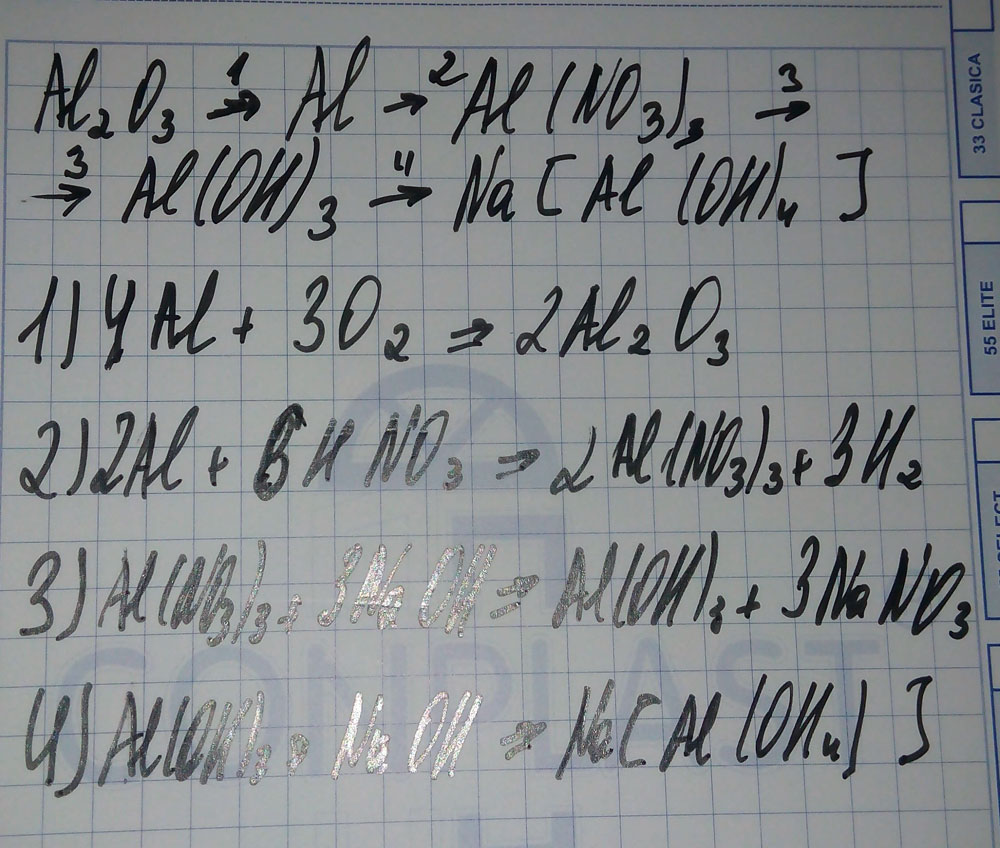
Осуществить превращение
Сера→ сульфид цинка→ сернистый газ→ сульфид натрия→ сернистый газ
1. Zn + S = ZnS (Сульфид цинка)
2. 2ZnS + 3O2 = 2ZnO + 2SO2 реакция пойдёт только при горении
3. SO2 + Na2O = Na2SO3 (сульфиД натрия)
4. Na2SO3 + HCl = NaCl + SO2 + H2O
Напишите уравнения реакций, с помощью которых можно осуществить превращение по схеме:
H2O→ O2→ Fe3O4→ Fe.
Укажите тип каждой химической реакции.
объясните как это делать
1. 2H2O => 2H2 + O2 реакция разложения. Реакция осуществима при пропускании постоянного электрического тока через воду.
2. 3Fe + 2O2 => Fe3O4 реакция соединения. Протекает при нагревании железа в кислороде (или на воздухе
3. Fe3O4 + 4H2 => 3Fe + 4H2O реакция замещения. Протекает при нагреве до 1000 градусов
Осуществите превращение веществ:
вода -> водород -> медь -> оксид меди(2)
1) реакция проходит под действием электрического тока
2H2O = 2H2+O2
2) как из водорода, эм. Получить медь.
можно попробовать электролизом, но
2CuSO4 + 2H2O = 2Cu + O2 + 2H2SO4;
тут творится что-то странное.
3) 2Сu + O2 = 2CuO
Водоро-вода-медь-оксид меди
Na2Co3-CaCo3-Co2 осуществить превращение. Написать в молекулярной и ионной форме
Составляем уравнения:
Na2CO3+CaCl2 = CaCO3+2NaCl молеулярное
+1 -2 +2 -1 +1 -1
2Na+CO3+Ca+2Cl = CaCO3+2Na+2Cl полное монное
+2 -2
Ca+CO3 = CaCO3 сокращ ионное
CaCO3+2HCl = CaCl2+H2O+CO2 молекулярн ое
+1 -1 +2 -1
CaCO3+2H+2Cl = Ca+2Cl = H2O+CO2 полное ионное
+1 +2
CaCO3+2H = Ca+H2O+CO2 сокращенное ионное
CuO-Cu(NO3)2-Cu(OH)2-CuO-Cu-CuO-CuCl2. Осуществить превращение. Не забудьте уравнять.
CuO + 2HNO₃ = Cu(NO₃)₂ +H₂O
Cu(NO₃)₂ + 2KOH = Cu(OH)₂ + 2KNO₃
Cu(OH)₂ = CuO + H₂O (t)
CuO + H₂ = Cu + H₂O
2Cu + O₂ = 2CuO
Вот:
1) CuO+H2 = Cu+H2O
2) Cu(NO3)2 + 2NaOH = Cu(OH)2 + 2NaNO3
3) Сu(OH)2 = CuO+H2
4) 2СuO = 2Cu + O2
5) 2Cu + O2 = 2CuO
6) СuO + 2HCl = CuCl2 + H2O