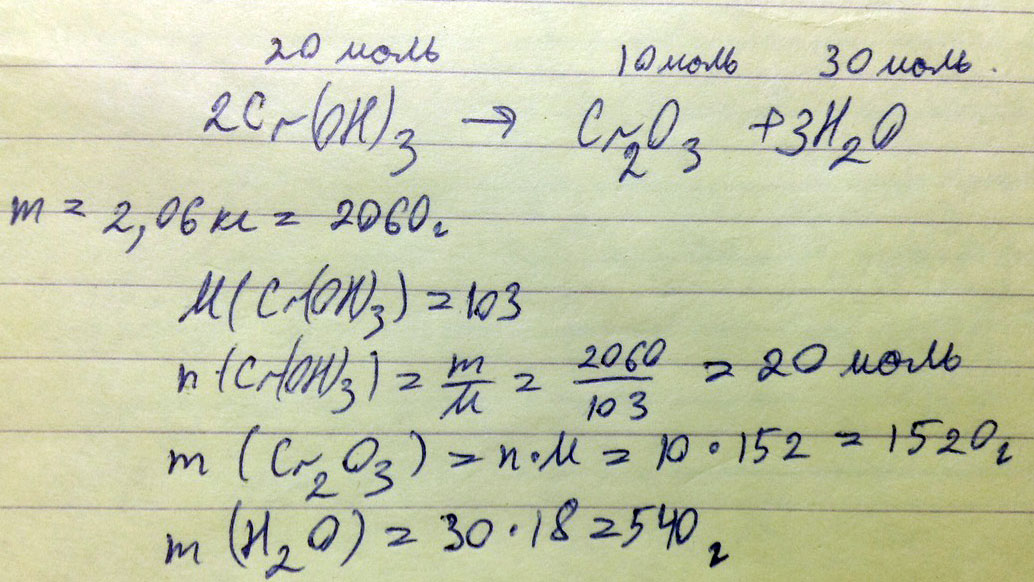Реакции разложения - задачи и примеры
При сжигании 117,8л природного газа, содержит 95% метана, выделится столько теплоты, что её хватило для разложения 3,0525 кг известняка, содержащего 20% примесей. Составьте термохимическую реакцию разложения карбоната кальция, если известно, что при сжигании 1 моль метана выделяется 880 кДж теплоты
Пишем обе реакции
1) CH4 + 2O2 = CO2 + 2H2O
2) CaCO3 = CO2 + CaO
Считаем сколько там чистого метана 117,8*95/100 = 111,91 л. И сразу его количество 111,91/22,4 = 5 моль. Значит энергии выделилось 880*5 = 4400 кДж.
Считаем сколько чистого карбоната кальция (переведем в граммы 3052,5*80/100 = 2442 г. И сразу его количество 2442/100 = 24,42 моль.
Если на 24,42 моль идет 4400 кДж, значит на 1 моль идет 4400*1/24,42 = 180,18 кДж. Пишем термохимичесое уравнение
CaCO3 = CO2 + CaO; ΔН = +180,18 кДж/моль
. Хотя в действительности при таком разложении выделяется 177,9 кДж/моль.
1. Группа веществ, в которой все вещества – кислоты, это…
A) CaH2, H2CO3 B) NH3, H2SO4 C) HBr, HNO3 D) AlH3, HCl E) K2S, HBr
2. Названия вещества Fe(OH)2
A) гидроксид железа B) гидроксид железа(II) C) гидрид железа (III)
D) гидрид железа (II) E) гидроксид железа(III)
3. Процесс окисления сложного вещества
A) горение серы B) горение угля C) горение сероводорода
D) разложения мела E) горение фосфора
4. При диссоциации NaNO3 в растворе образуются ионы
A) H3+ и PO43- B) H+ иCl- C) Al3+ и Cl- D) Na+ иNO3- E) Na+ и Cl-
5. Диссоциирует кислота
A) NaOH Na++OH- B) HCl H++Cl- C) Ba(OH)2 Ba2++2OH-
D) FeCl2 Fe2++2Cl- E) KCl K++Cl-
6. Порядковый номер азота
A) 9 B) 5 C) 7 D) 8 E) 6
7. Молекулярные массы озона О3 и кислорода О2 отличаются в. Раз
A) 16 B) 32 C) 1 D) 1,5 E) 8
8. Экзотермическая реакция
A) N2+O2 = 2NO B) МgCO3= MgO + CO2C) 2H2O = O2 + 2Н2
D) 2NH3 = N2 +3H2 E) S+O2 =SO2
9. Коэффициенты в уравнении реакции. Аl +. O2 =. Al2O3 соответственно
A) 1,2, 3B) 3,4, 1C) 4,3, 2D) 4,2, 3E) 4,2, 2
10. Между собой не взаимодействуют оксиды
A) Na2O иSiO2 B) ZnO иSO3 C) CaO иCO2 D) BaO иCO2 E) P2O5 иNO2
11. Вещество “X” в схеме превращений
FeO XFeCl2
A) Fe(OH)2 B) FeCl3 C) Fe2O3 D) Fe E) FeCl2
12. Электронная конфигурация 1s22s22p63s23p6 соответствует частице
A) Na+ B) K+ C) Cа0 D) Р+5 E) Li+
13. Молекулярная кристаллическая решетка характерно для
A) KCl B) MgBr2 C) KClO3 D) NaJ E) Cl2
14. Количество всех ионов, образующихся при полной диссоциации 3 моль серной кислоты
A) 12 B) 8 C) 10 D) 9 E) 16
15. Суммарное уравнение диссоциации ортофосфорной кислоты
A) H3PO4 3H+ + B) H3PO4 H+ + H2PO4–
C) H3PO4 H+ + D) H3PO4 2H+ +
E) H+ +
16. В схеме превращений:
Naà NaOHà NaClà NaNO3
правильная последовательность добавления реагентов, это
A) H2O, HCl, Pb(NO3)2 B) O2, HCl, HNO3
C) O2, KCl, HNO3 D) O2, HCl, AgNO3 E) H2O, KCl, AgNO3
17. Масса водорода, необходимая для восстановления 7,2 г оксида железа (ІІ)
A) 20 г B) 1 г C) 2 г D) 0,2 г E) 0,1 г
18. Масса 50 моль воды
A) 540г B) 1800г C) 360г D) 180 г E) 900г
19. Объем (н.у.) оксида азота (IV), образующегося при взаимодействии
12,8 г меди с концентрированной азотной кислотой
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
A) 8,96 л B) 5,6 л C) 11,2 л D) 33,6 л E) 22,4 л
20. 5,4 г алюминия поместили в воду и получили водородобьемом (н.у.)
A) 22,4 л B) 67,2 л C) 6,72 л D) 33,6 л E) 44,8 л
1. C 11.
2. B 12. B
3. C 13. E
4. D 14. D
5. B 15.
6. C 16. E
7. D 17. E
8. E 18. E
9. C 19.
10. A 20.
Вычислить объем СО2 который выделился при разложения 100г мела при нагревании
100г х л
CaCO3 = CaO+CO2 х=100*22,4/100 = 22,4 л
100 22,4
Дано:
m(СаСО3)=100г
Найти:
V(СО2)=?
Решение:
m = 100г V=?
СаСО3 = СаО+СО2
m = 100г V = 22,4 лмоль
m = M*n
М(СаСО3)=40+12+16*3 = 100гмоль
m = 100гмоль*1моль=100г
V = Vm*n
Vm = 22,4 лмоль
V = 22,4 лмоль*1 моль=22,4 л
100 = х
100 22,4
Решаем пропорцией
х=100*22,4100 = 22,4
Ответ: V(СО2)=22,4 л
В результате реакции разложения гидроксида хрома(III) образуется оксид хрома(III) и вода. Определите массы продуктов реакции, полученных при разложении 2,06 кг гидроксида хрома(III)
Граммы - это система СИ.
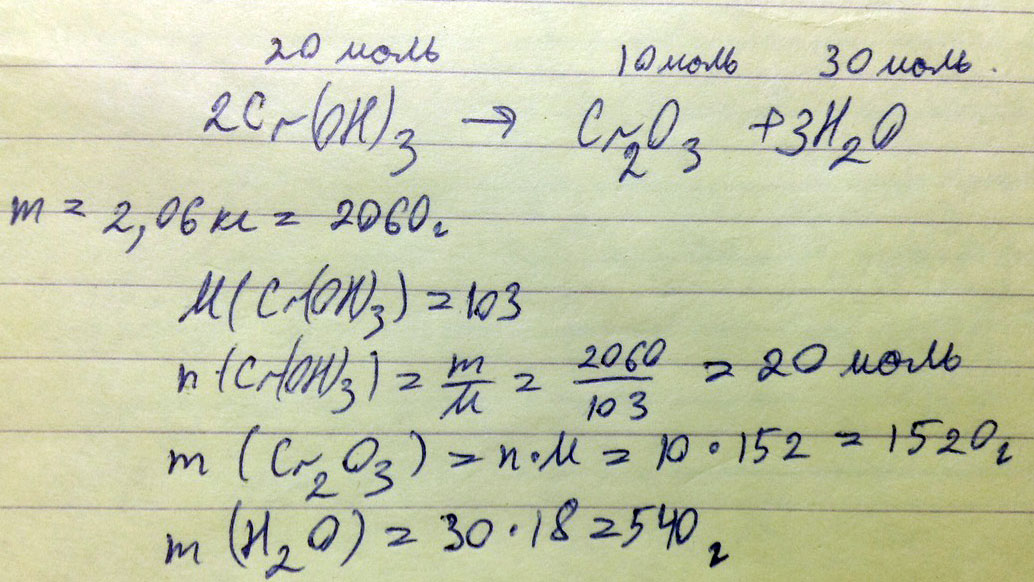
Вычислите объем кислорода, выделившегося в результате разложения 9г воды.
Дано:
m(H₂O)=9г
Найти:
V(O₂) -
Решение:
2H₂O → 2H₂ + O₂
Mr(H₂O)=1*2+16 = 18 гмоль
n(H₂O)=9г: 18гмоль = 0,5 моль
n(O₂) = n(H₂O)
1 : 2
n(O₂)= 0,5 / 2= 0,25 моль
V = Vm*n
V(О₂) = 22,4 лмоль * 0,25 моль = 5,6 л
Ответ: V(O₂) = 5,6 л
С гидроксидом кальция реагирует каждое из двух веществ:
1) оксид меди (II) и гидроксид цинка
2) оксид углерода (IV) и азотная кислота
3) сероводород и кислород
4) хлороводородная кислота и водород
211. С раствором гидроксида бария реагирует каждое из двух веществ, формулы которых:
1) Na2SО4 и СО2
2) КNО3 и FеО
3) К2О и Н2SiO3
4) Мg(ОН2 и NO
212. С раствором гидроксида кальция реагирует
1) оксид углерода (IV)
2) нитрат натрия
3) оксид магния
4) гидроксид бария
213. С раствором гидроксида натрия реагирует вещество, формула которого
1) K2S
2) NO
3) НЗРО4
4) Ва(NОЗ2
214. В результате разложения гидр оксида меди(II) образуются
1) → СuОН + Н2
2) → Сu + Н2О
3) → СuОН + Н2
4) → СuО+ Н2О
215. С гидроксидом калия не реагирует
1) соляная кислота
2) оксид бария
3) оксид углерода (IV)
4) кремниевая кислота
216. С гидроксидом бария реагирует вещество, формула которого
1) P2O5
2) NаNОз
3) СuО
4) КОН
21 7. С гидроксидом натрия реагирует
1) серная кислота
2) хлорид бария
3) оксид кальция
4) гидроксид кальция
218. С гидроксидом алюминия не реагирует раствор
1) азотной кислоты
2) гидроксида бария
3) соляной кислоты
4) сульфата натрия
219. В реакцию с азотной кислотой вступает
1) оксид серы (VI)
2) гидроксид железа (II)
3) фосфорная кислота
4) хлорид магния
220. В реакцию с разбавленным раствором серной кислоты вступает
1) медь
2) оксид кремния
3) нитрат меди (II)
4) оксид меди (II)
221. С раствором соляной кислоты не реагирует
1) оксид натрия
2) оксид углерода (IV)
3) нитрат серебра
4) гидроксид меди (II)
222. Раствор серной кислоты реагирует с каждым из двух веществ:
1) Zn и СаО
2) Mg и HCl
3) Сu(ОН2 и N2
4) BaCl2 и Н2
223. Раствор азотной кислоты реагирует с каждым из двух веществ:
1) Mg(OH)2 и СО2
2) Си и Н2О
3) СаСО3 и Na2O
4) BaSO4 и H2S
224. Раствор серной кислоты реагирует с каждым из двух веществ:
1) Nа2СО3 и СuО
2) Mg(OH)2 и HCI
3) Сu и SОз
4) BaCl2 и Н2О
225. Раствор ортофосфорной кислоты реагирует
1) КNОз
2) H2S
3) СO2
4) ВаО
226. Раствор азотной кислоты реагирует с каждым из двух веществ:
1) Zn и Сu(ОН2
2) МgО и НСl
3) NO2 и SiO2
4) Ва(NОЗ2 и Н2
227. Раствор азотной кислоты реагирует с каждым из двух веществ:
1) NаЗРO4 и SО3
2) Н3РO4 и HCI
3) СиО и Zn(OH)2
4) MgCl2 и O2
228. Раствор соляной кислоты реагирует с каждым из двух веществ:
1) АgNОз и Сu(ОН2
2) СаО и НВr
3) Hg и СO2
4) Ва(NОЗ2 и S
229. Раствор соляной кислоты реагирует с каждым из двух веществ:
1) Мg(NОЗ2 и Сu
2) Na2O и Fе(ОНз
3) Сu и H2SO4
4) Н2СОЗ и SO2
210. 2
211. 1
212. 1
213. По-моему тут подходит и 2, и 3. Хотя если нет возможности двух ответов напишите 3
214. 4
215. 2
216. 1
217. 1
218. 4
219. 2
220. 4
221. 2
222. 1
223. 3
224. 1
225. 4
226. 1
227. 3
228. 1
229. 2
В результате реакции разложения гидроксида железа (III) образуются оксид железа (III) и вода. Определите массы продуктов реакции, полученных при разложении 100 г технического гидроксида железа, содержащего 14,4% примесей.
M(Fe(OH)3)=100
14.4%
100*0.856 = 85.6
M(Fe(OH)3)=56+48+3 = 107
mol = 0.8
2Fe(OH)3 = Fe2O3 + 3H2O
Пропорция к Fe2O3
0.8/2 = x/1
x = 0.4
M(Fe2O3)=56*2+48 = 160
m(Fe2O3)=160*0.4 = 64
Пропорция к H2O
0.8/2 = x/3
x = 1.2
M(H2O)=18
m(H2O)=1.2*18 = 21.6
ответ
m(Fe2O3)=64
m(H2O)=21.6
1. Укажите формулу вещества, воспламенение, который сформировал оксида железа (ІІ):
а Fe ( SO4)3 б Fe(OH)3 в Fe(OH)2 г Fe(NO)3 д Fe(NO3)2
2. Выберите метод очистки раствора хлорида железа 2 от примесей медь 2 хлорид:
а) поместить в раствор сетку железа,
б) добавить раствор нитрата аргентум,
в) поместить в раствор цинковый диск,
г) добавить нитратную кислоту,
д) поместить в раствор серебряный диск.
3. Масса железа 21 г, содержит определенную долю примесей, обработанных хлоридной кислотой, обращается в избытке. После полного окисления газ, который был передан, использовали газ, полученный во время термического разложения 13.88 г хлората калия. Найдите и выберите массовую долю (%) примеси железа:
а 16,4% б 9,3% в 3,8% г 6,4% д 90,%
)
1. В
2. А
3.
Дано:
m’(Fe) = 21 г
m(KClO3) = 13,88 г
ω(примеси -
13.88 г х л
а 2KClO3 => 2KCl + 3O2↑
245 г 67,2 л
х=V(O2) = 3,81 л
х л 3,81 л
б 2H2 + O2 = 2H2O
2 л 1 л
х=V(H2) = 7.62 л
х г 7,6 л
в Fe + 2HCl = FeCl2 + H2↑
56 г 22,4 л
х=m(Fe) = 19,05 г - масса чистого железа
m(примесей = 21 г - 19,05 г = 1,95 г
ω(примесей = 1,95 г/21 г×100% = 9,3%
Ответ: б - 9,3%
Через герметический сосуд, заполненный двумя молями подкисленной воды, пропущен электрический ток до разложения половинного количества воды. Вычислите, считая воду несжимаемой, давление в сосуде при 0 градусах цельсия
1) реакция разложения воды: 2H2O = 2H2 + O2
2) из одного моля воды выделяется три моля газа(O2 + H2), соответственно из половины от двух молей воды выделится два моля H2 и один моль О2, значит v₁=2,v₂=1
3) Так как сосуд заполнен, то в нем изначально нет воздуха, а лишь вода, тогда сможем расчитать его объем: считая плотность воды 1г/см3, найдем что объем двух моль воды равен: V = m/q = M*v/q = 18*2/1 = 36(cм3)=3,6*10⁻⁵(л)
4) Так как половина воды разложилась, то вода стала занимать лишь половину объема(1,8*10⁻⁵л, оставив вторую часть(V = 1,8*10⁻⁵) для газа.
5) Из закона Дальтона для идеальных газов, давление смеси газов(p₀) равно сумме давлений газов в смеси: p₀=p₁+p₂
6) Из закона Менделеева-Клапейрона состояния идеального газа выразим давление: pV = v*R*T, p = v*R*T/V. Объем и температура у обоих газов в смеси одинаковы.
7) подставим полученную формулу(6) в формулу(5):
p₀=v₁*R*T/V+v₂*R*T/V, вынесем общее за скобки: p₀=(v₁+v₂)*R*T/V
8) теперь подставим значения в полученную формулу (7):
p₀=(2+1)*8,31*273/1,8*10⁻⁵ = 378105000(Па = 378,11(КПа
Вычислить объем кислорода при нормальных условиях если в реакции разложения использовали 4 моль V2O5
Напишем-ка реакцию разложения несчастного оксида ванадия:
2V₂O₅ → 4V + 5O₂
По стехиометрическим коэффициентам видно, что n(O₂) = 2,5*n(V₂O₅) = 4*2,5 = 10 (моль, тогда просто вычисляем V(O₂) = Vm*n(O₂) = 22,4*10 = 224 (л)