Напишите уравнения реакций - задачи и примеры
- Уравнения реакций, с помощью которых можно осуществить превращения
- Уравнения в молекулярной, полной ионной и сокращенной ионной формах
- Уравнения реакций превращения веществ
- Уравнение реакции получения
- Уравнения реакций взаимодействия веществ
- Уравнения реакций между следующими веществами
Напишите уравнение реакций, подтверждающих кислотно-основный характер высшего оксида и гидроксида фосфора, лития и серы.
Кислотные оксиды взаимодействуют с водой, с основными оксидами, со щелочами:
P₂O₅ - оксид фосфораV) кислотный оксид:
P₂O₅ + 3H₂O = 2H₃PO₄
P₂O₅ + CaO = Ca₃(PO₄)₂↓
P₂O₅ + 6NaOH = 2Na₃PO₄ + 3H₂O
Гидроксид фосфора H₃PO₄ - фосфорная кислота. Фосфорная кислота взаимодействует с металлами, с оксидами металлов, с основаниями, с солями:
2H₃PO₄ + 3Mg = Mg₃(PO₄)₂↓ + 3H₂↑↑
H₃PO₄ + ZnO = Zn₃(PO₄)₂↓ + H₂O
H₃PO₄ + 3NaOH = Na₃PO₄ + 3H₂O
3H₃PO₄ + 3MgCI₂ = Mg₃(PO₄)₂↓↓ + 6HCI
SO₃ - оксид серы(IV) кислотный оксид:
SO₃ + H₂O = H₂SO₄
SO₃ + BaO = BaSO₄↓
SO₃ + KOH = K₂SO₄
Основные оксиды щелочных и щелочноземельных металлов взаимодействуют с водой, с кислотными оксидами, с кислотами.
Li₂O - оксид лития основной оксид щелочного металла:
Li₂O + H₂O = 2LiOH
Li₂O + CO₂ = Li₂CO₃
Li₂O + 2HCI = 2LiCI + H₂O
Напишите уравнение реакций Ba-BaO-BaSO4-BaCl2
Ba →BaO →BaSO₄→ BaO →BaCI₂
2Ba + O₂ = 2BaO
BaO +H₂SO₄ = BaSO₄↓ +H₂O
из сульфата бария не возможно напрямую получить хлорид бария, поэтому в цепочку дополнительно вводим оксид бария BaO
2BaSO₄ +t 1600⁰C= 2BaO + 2SO₂↑ + O₂↑
BaO + 2HCI = BaCI₂ + H₂O
В трёх сосудах содержатся концентрированные растворы серной, азотной и соляной кислот. Имея в своём распоряжении лишь кусочки меди, определить эти вещества. Напишите уравнения реакций.
1) Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O (Можно определить, что это азотная кислота потому, что NO2 - бурый ядовитый газ, здесь играет роль именно цветовая гамма газа
2) Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O (Можно определить из известных условий задачи, так как с соляной кислотой реакции не будет, а в реакции с азотной кислотой выделится легко узнаваемый по цвету газ
3) Cu + HCl - реакции не будет, так как медь не реагирует с соляной кислотой, при том любой концентрации.
Зная, как физически разделить смесь железных и медных опилок, отделите медь химическим методом. Напишите уравнение реакций
Железные опилки растворятся в сильной кислоте (железо левее водорода в электрохимическом ряду), медные — не растворятся (медь правее).
Например: Fe + 2HCl = FeCl₂ +H₂↑
Только не брать азотную кислоту! В ней растворятся и те, и эти (там восстанавливается не водород кислоты, а азот).
Напишите уравнение реакций, дайте название вещевств
КАЛИЙ+ХЛОР=
калий+кислород=
калий+водород=
калий+сера=
калий + вода=
калий+соляная кислота=
калий+серная кислота=
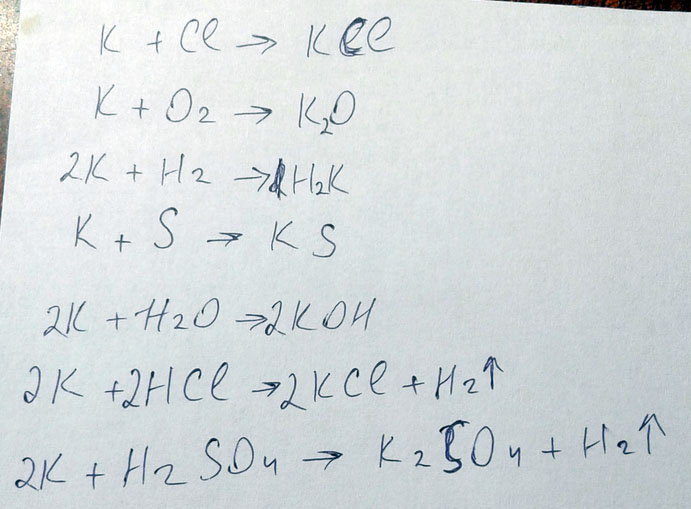
Напишите уравнение реакций хлора со следующими веществами: кальций, железо, водород, бромид калия. Рассмотрите приведённых вами уравнения с окислительно-восстановительной точки зрения.
Са+Cl2 = CaCl2
Ca⁰-2e = Ca⁺²-восстановитель
Cl2⁰+2e = 2Cl⁻ -окислитель
2Fe+3Cl2 = 2FeCl3
Cl2⁰+2e = 2Cl⁻-окислитель
Fe⁰-3e = Fe⁺³-восстановитель
H2+Cl2 = 2HCl
Cl2⁰+2e = 2Cl⁻-окислитель
H2⁰-2e = 2H⁺-восстановитель
2KBr+Cl2 = 2KCl+Br2
Cl2⁰+2e = 2Cl⁻-окислитель
2Br⁻-2e = Br2⁰-восстановитель
Как получить металл из WO3? Напишите уравнение реакций.
Разберите их с точки зрения окисления-восстановлеения
Для восстановления тяжелых металлов из их оксидов, обычно используется водород.
WO3+3H2 = W+3H2O
Водород проявляет в данном случае восстановительные свойства.
H2(0) -2e 2H(+) •3
W(+6)+6e W(0) •1
К какому классу соединений относиться Fe(OH)2. Напишите уравнение реакций, характеризующие его свойства.
Класс - основание нерастворимое
Проявляет свойства основания — легко вступает в реакции нейтрализации с разбавленными кислотами, например с соляной (образуется раствор хлорида железа(II)):
В более жёстких условиях проявляет кислотные свойства, например с концентрированным (более 50 %) гидроксидом натрия при кипении в атмосфере азота образует осадок тетрагидроксоферрата(II) натрия:
Не реагирует с гидратом аммиака. При нагревании реагирует с концентрированными растворами солей аммония, например, хлорида аммония:
При нагревании разлагается с образованием оксида железа(II):
В этой реакции в качестве примесей образуются металлическое железо и оксид дижелеза(III)-железа(II) (Fe3O4).В виде суспензии, при кипячении в присутствии кислорода воздуха окисляется до метагидроксида железа. При нагревании с последним образует оксид дижелеза(III)-железа(II):
Эти реакции также происходят (медленно в процессе коррозии железа.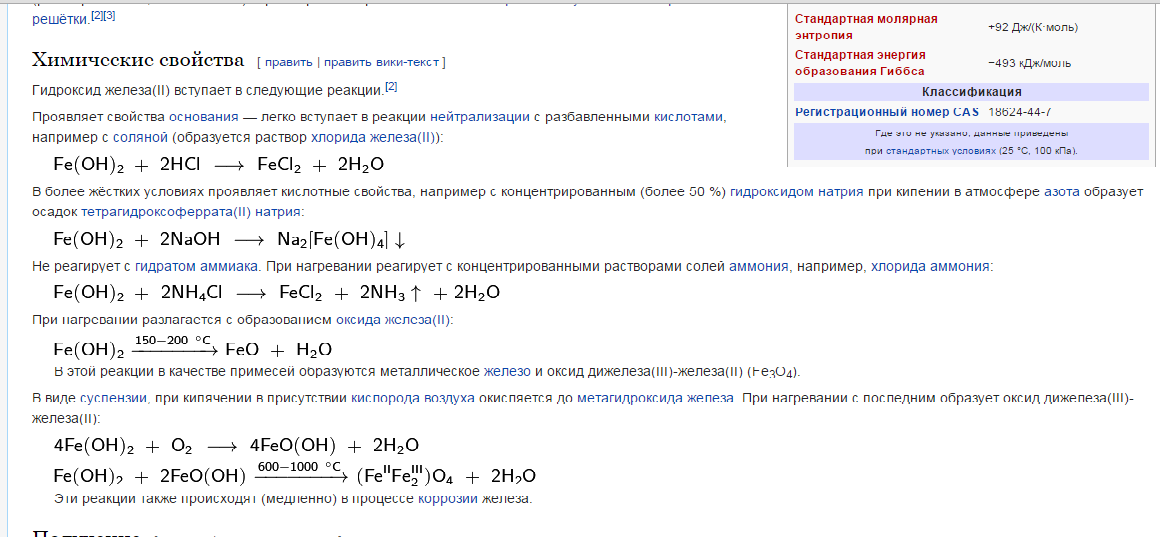
Напишите уравнение реакций, которые доказывают: а) NH4Cl содержит ионы NH4 и Cl б) (NH4)2SO4 содержит ионы NH4 и SO42-
Используем качественные реакции на катионы и анионы.
чтобы определить ион аммония: NH4+ + ОН- NH3+ Н20 выделяется газ с характерным резким запахом
чтобы определить ион хлора: Аg+ +CI- AgCl выпадает белый хлопьевидный осадок
чтобы определить сульфат-ион:
Ва2+ + S042- BaS04 выпадает белый осадок, нерастворимый в кислотах