Молекулярное уравнение – это химическое уравнение, которое описывает реакцию между отдельными молекулами веществ. В молекулярном уравнении все вещества представлены в виде молекул и не разделяются на ионы. Такое уравнение позволяет увидеть, как именно происходит взаимодействие отдельных молекул и какие вещества образуются в результате реакции.
Молекулярными уравнениями мы часто пользуемся на уроке.
Например: NaOH + HCl -> NaCl + H2O
CuO + H2SO4 -> CuSO4 + H2O
H2SO4 + 2KOH -> K2SO4 + 2H2O и т.д.
Ионное уравнение (ионно-молекулярное), в отличие от молекулярного уравнения, учитывает разделение некоторых веществ на ионы. Вещества, которые в ионно-молекулярном уравнении представлены в виде ионов, могут быть разложены на положительно и отрицательно заряженные частицы. Это позволяет увидеть, какие ионы образуются в результате реакции и как именно они взаимодействуют между собой.
Другими словами, некоторые вещества растворяются в воде, образуя при этом ионы. Эти вещества можно записать с помощью ионов. А малорастворимые или труднорастворимые оставляем в первоначальном виде. Это и есть ионное уравнение.
Например:
1) CaCl2 + Na2CO3 -> NaCl + CaCO3 - молекулярное уравнение
Ca+ 2Cl+ 2Na+ CO3 -> Na+ Cl+ CaCO3 - ионное уравнение
Cl и Na остались такими же, какими они были до реакции, т.е. они не приняли в ней участие. И их можно убрать и из правой, и из левой частей уравнения. Тогда получается:
Ca + CO3 -> CaCO3
2) NaOH + HCl -> NaCl + H2O - молекулярное уравнение
Na+ OH+ H+ Cl -> Na+ Cl+ H2O - ионное уравнение
Na и Cl остались такими же, какими они были до реакции, т.е. они не приняли в ней участие. И их можно убрать и из правой, и из левой частей уравнения. Тогда получается: OH + H -> H2O
Как составить и решить ионные уравнения?
Записываем молекулярное уравнение химического процесса.
$$ H_2SO_4 + KOH = K_2SO_4 + H_2O $$Балансируем молекулярное уравнение с помощью коэффициентов. Чтобы правильно сбалансировать равенство, нужно вспомнить закон сохранения массы веществ, согласно которому в ходе химических превращений новые атомы не появляются, а старые не разрушаются. Т.е. число атомов в продуктах реакции равно числу атомов в исходных веществах. Помним, что водород и кислород уравниваем в последнюю очередь.
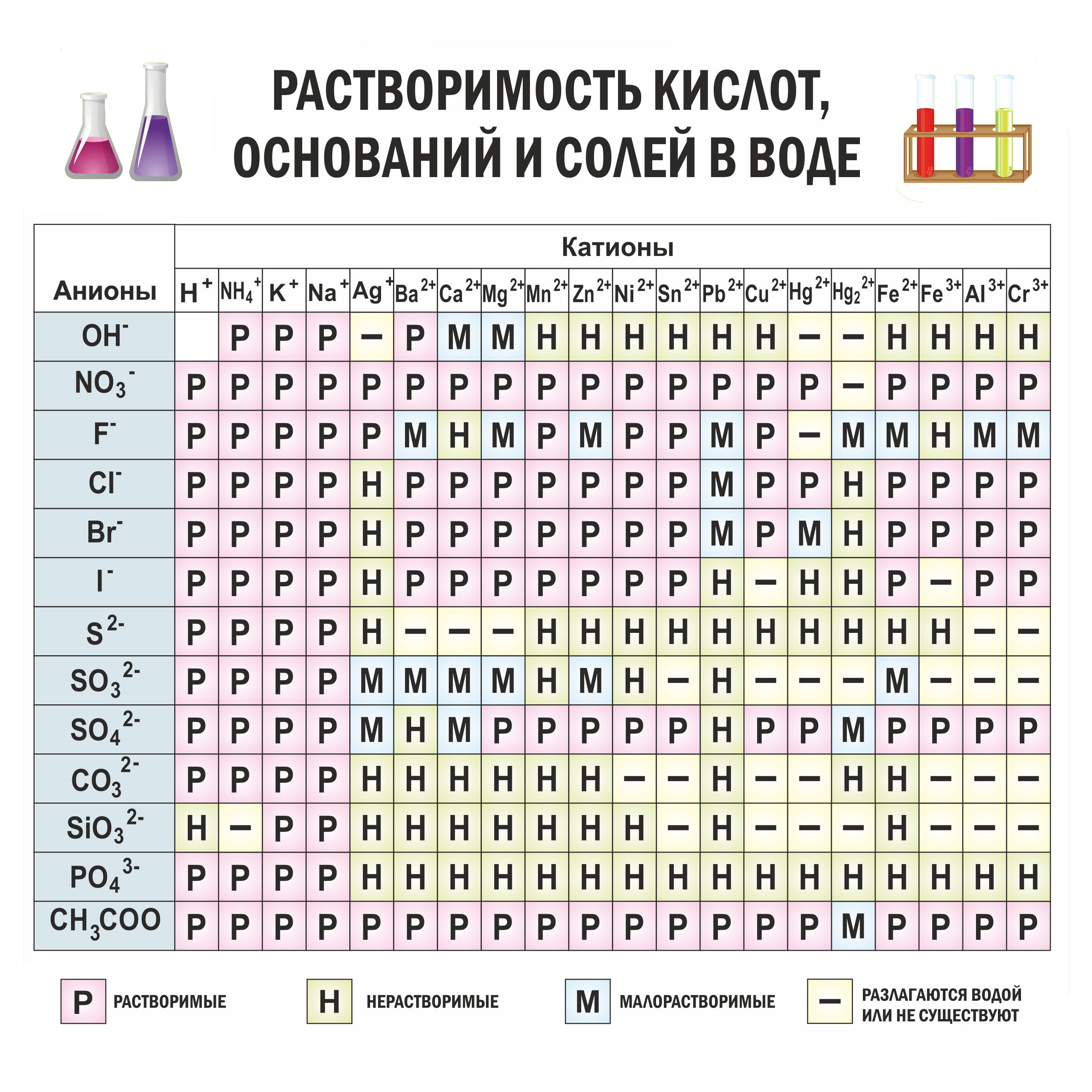
$$ H_2SO_4 + 2KOH = K_2SO_4 + 2H_2O $$Определяем, какие вещества в химической реакции диссоциируют, т.е. распадаются на ионы. В этом поможет таблица растворимости солей и оснований. Если соль растворима, потребуется разложить ее на ионы, например,
NaCl = Na+ + Cl-
K2SO4 = 2K+ + SO4 2-
или основание: Ba(OH)2 = Ba 2+ + 2OH -
2) Не раскладываются на ионы газы CO2, SO2, H2S
3) Не раскладываются на ионы слабые электролиты H2O, H3PO4, H2SiO3
4) Если в результате реакции обмена в продуктах образуется угольная кислота H2CO3, то ее нужно сразу разложить на газ и воду: CO2 и H2O. Также поступаем и с сернистой кислотой: SO2 и H2O
Записываем в виде ионов: растворимые соли; сильные кислоты (H2SO4, HNO3, HCl и др.); растворимые в воде основания.
Записываем в виде молекул: нерастворимые соли; слабые кислоты, щелочи, вода; оксиды; газы; простые вещества; большинство органических соединений.
Если есть сомнения в растворимости реагента или продукта реакции, проверяем по таблице растворимости, которая является справочным материалом, ей можно пользоваться на экзаменах. В таблице, помимо растворимости соединений, представлены также заряды катионов и анионов, участвующих в реакциях.
Например: Na2SO4 + BaCl2 = ...
Мы имеем дело с реакцией ионного обмена. В реакцию вступают два соляных раствора: сульфат натрия и хлорид бария. В результате реакции выпадает нерастворимый осадок сульфата бария и образуется раствор поваренной соли. Уравнивая коэффициенты в соответствии с зарядами ионов, имеем:
Na2SO4 (р) + BaCl2 (р) = BaSO4↓(осадок) + 2NaCl(р)
Количества ионов в обоих частях равенства должно быть одинаковым. Полное ионное уравнение реакции будет выглядеть так:
2Na+ + SO42- + Ba2+ + 2Cl- = BaSO4↓ + 2Na+ + 2Cl-
Вычёркиваем одинаковые ионы в левой и правой частях уравнения. Сокращенное ионное уравнение реакции:
SO42- + Ba2+ = BaSO4↓
ОСОБЕННОСТИ ИОННЫХ УРАВНЕНИЙ
1. Реакции ионного обмена, в отличие от окислительно-восстановительных реакций, протекают без нарушения валентности веществ, вступающих в химические превращения.
2. Реакции между ионами протекают при условии образования в ходе реакции плохорастворимого осадка, выделения летучего газа или образования слабых электролитов. CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl
Na2CO3 + 2HCl = 2NaCl + CO2↑+ H2O
Примечательно, что реакции обмена могут проходить даже с нерастворимыми солями слабых кислот. В этом случае сильная кислота вытесняет слабую из ее солей. В качестве примера можно привести сокращенное ионное уравнение разведения карбоната кальция в сильных кислотах.
Объясните, как разбирать сокращенные и полные ионные уравнения
Смотрим, какие вещества растворимы (для удобства можно внизу написать н, р).
Если вещество растворимо, то пишем, на какие ионы оно распадается. Это можно определить по таблице растворимости.
Далее, когда составим полное ионое уравнение, то, если есть и в правой и в левой частях одинаковые ионы, сокращаем их. В результате получим краткое уравнение.
Пример: $$ H_2SO_4 + 2NaOH = Na_2SO_4 + 2H_2O \\ 2H+ 2Na+ SO_4 (\text{валентность} 2-) + 2OH = 2Na + SO_4 (\text{валентность} 2-) + 2H_2O \\ 2Н + 2OH = 2H_2O \\ H + OH = H_2O $$