Чем отличаются изотопы от химических элементов
Они различают по количеству нейтронов в ядре атомов. Изотопы это один и тот же элемент, с одинаковым зарядом ядра, с одинаковыми числами электронов. Отличаются только по массе (Ar)
Они различают по количеству нейтронов в ядре атомов. Изотопы это один и тот же элемент, с одинаковым зарядом ядра, с одинаковыми числами электронов. Отличаются только по массе (Ar)
Изото́пы арго́на — разновидности атомов(и ядер химического элемента аргона, имеющие разное содержание нейтронов в ядре. Аргон представлен в земной атмосфере тремя стабильными изотопами: 36Ar (0,337 %), 38Ar (0,063 %), 40Ar (99,600 %)[1][2]. Почти вся масса тяжёлого изотопа 40Ar возникла на Земле в результате радиоактивного изотопа калия 40K (содержание этого изотопа в изверженных породах в среднем составляет 3,1 г/т
Чтобы определить число протонов, нужно посмотреть на порядковый номер. Например порядковый номер фосфора равен 15, значит и протонов будет 15. Столько же и электронов, т. к. Число протонов ВСЕГДА равно числу электронов.
Чтобы найти число нейтронов, нужно от относительной массы отнять порядковый номер
Потому что атомная масса водорода гораздо меньше массы хлора. К ваодороду прибавишь один нейтрон - и он в два раза тяжелее становится. С хлором такое не прокатит
Для удобства видимости всех изотопов, формулу воды будем изображать в виде НОН (решение на рисунке.
Самая "легкая" вода ¹H¹⁶O¹H (Mr = 1+16+1 = 18, т.е. Самая обыкновенная вода и есть самой легкой
Самая "тяжелая" вода ³H¹⁸O³H (Mr = 3+18+3 = 24)
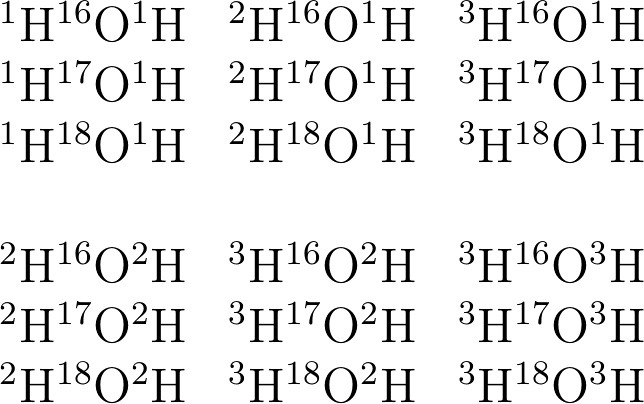
Углерод имеет два стабильных изотопа — 12C и 13C. Содержание этих изотопов в природном углероде равно соответственно 98,93 % и 1,07 %. Известны также 13 радиоактивных изотопов углерода (от 8C до 22C), из которых один — 14C — встречается в природе (его содержание в атмосферном углероде около 10−12).
Понятие атом возникла в древнем мире для обозначения частиц вещества. В переводе с греческого означает "неделимый". После открытие явления радиоактивности было доказано что атом имеет сложное строение, состоит из более мелких элементарных частиц. Резерфорд предложил планетарную модель атома (Аналогично солнечной системе. Атомное ядро, в котором сосредоточена вся масса атомов состоит из протонов и нейтронов. Протоны имеют заряд равный + 1 и массу равную 1. Нейтроны не имеют заряда имеют массу равную массе протона (=1). Электроны вращаются вокруг положительно заряженного ядра, имеют заряд -1 и маленькую массу, которой можно пренебречь. Суммой протонов и нейтронов называется массовое число. Так как атом электронейтрален, то число протонов и электронов в атоме одинаково. Оно равно порядковому номеру элемента. Порядковый номер элемента определяет: 1. Общее число электронов в атоме,
2. Число протонов в ядре атома,
3. Число нейтронов равно разности относительной атомной массы (Ar) и порядкового номера.
С точки зрения строения атома, химический элемент- это совокупность атомов с одинаковым зарядом ядра.
Разновидности атомов одного и того же элемента, имеющие одинаковый заряд ядра, но разное массовое число, называются изотопами. Изотопы существуют в природе и их можно получить в результате ядерных реакций. Химические элементы, встречающиеся в природе, являются смесью изотопов. С (углерод имеет 3 изотопа: +6С12, +6С13, +6С14 (+6-иднекс слева внизу; 12,13,14- степени слева наверху. Для водорода H известны три изотопа: +1Н1- протий, +1Н2- дейтерий, +1Н3- тритий (+1-иднекс слева внизу, 1,2,3- степени слева наверху. Ядерные реакции происходят на солнце а также научились проводить их на Земле. Изотопы одного и того же элемента имеют разные относительные атомные массы, поэтому относительная атомная масса химического элемента является средним значением атомных масс природных изотопов с учётом их содержания в природе.
Ar (Cl)= 35,5
35^Cl; 37^Cl.
Ar (Cl)= 35,5×0,75+37×0,25/2 = 35,5.
Атом состоит из электронов и ядра(которая состоит из протонов и нейтронов и элементарных частиц.
Ядро содержит положительно заряженные протоны и нейтроны(нейтральная т.е. Незаряженная.
Число протонов-порядковый номер в периодической таблице и заряд ядра.
Изотопы (одинаковый заряд, разные массы то есть нейтронов в изотопах больше. Например изотоп 81Br отличается от 80Br одним нейтроном.
В атоме водорода (1H) 1 протон, 1 электрон, 0 нейтронов.
В атоме углерода (12C) 6электронов, 6 протонов и 6 нейтронов
В молекуле углеводорода N(e) / N(n) = 1.5;
Количество нейтронов обусловлено только наличием атома углерода 12С.
Допустим что углерод 1, тогда N(e) = 1,5 * 6 = 9.
Единственный углеводород с одним углеродом это метан CH4, но у него 6+4 = 10 электронов. Не подходит.
Допустим что углеродa 2, тогда N(e) = 1,5 * 2*6 = 18.
Если это алкан, то углеводород — это этан C2H6, тогда 6*2 + 1*6 = 18 электронов.
Атом изотопа $$ C_nH_m $$ содержит 6n нейтронов и 6n + m электронов.
По условию: 6n + m = 1,5·6n.
Откуда: m = 3n.
Углеводород с формулой CH₃ невозможен.
Поэтому искомое вещество: C₂H₆ - этан.