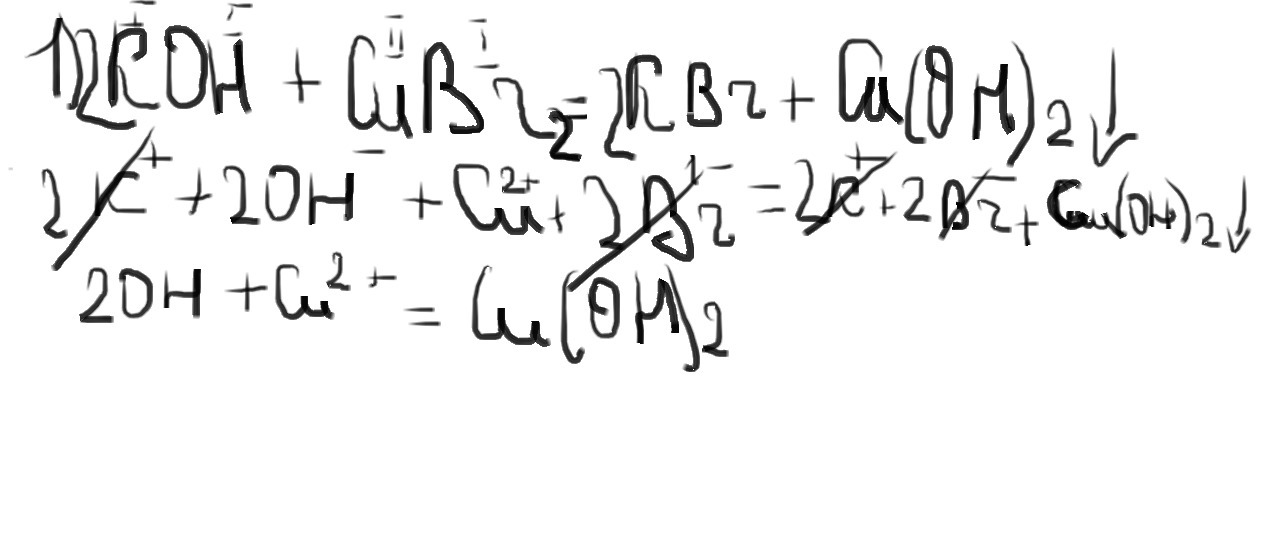Даны вещества Ag, H2SO4(разб. ), CuO, Fe, NaOH,(CuOH)2CO3.
Используя воду и необходимые вещества только из этого списка, получите в две стадии медь. Опишите признаки проводимых реакций. Для реакции ионного обмена напишите сокращенное ионное уравнение
1. Fe + H2SO4(разб. ) = FeSO4 + H2
Происходит растворение железа с образованием бесцветного газа
2. CuO + H2 = Cu(стрелка вниз+ H2O
Образование красно-кирпичной меди
Здесь нет реакций ионного обмена.
Составьте уравнения соответствующих реакций. Реакции ионного обмена запишите так же в ионной форме.
CuSO4-> Cu(OH)2-> CuO-> Cu
,
MgCO3->MgCl2->Mg(OH)2->MgSO4
-
MgO+CO2->MgCO3 (Реакция протекает не в растворе
MgCO3+2HCl->MgCl2+CO2+H2O (MgCO3 - гидролизуется в растворе
Mg(2+)+CO3(2-)+2H(+)+2Cl(-)->Mg(2+)+2Cl(-)+CO2+H2O (полное ионное уравнение
CO3(2-)+2H(+)->CO2+H2O (малое ионное уравнение "сокращенное")
MgCl2+2NaOH->Mg(OH)2+2NaCl (молекулярное уравнение
Mg(2+)+2Cl(-)+2Na(+)+2OH(-)->Mg(2+)+2OH2(-)+2Na(+)+2Cl(-) (полное ионное уравнение
Mg(2+)+2OH(-)->Mg(OH)2 (малое ионное уравнение "сокращенное")
Mg(OH)2+H2SO4->MgSO4+2H2O (молекулярное уравнение
Mg(2+)+2OH(-)+2H(+)+SO4(2-)->Mg(2+)+SO4(2-)+2H2O (полное ионное уравнение
2OH(-)+2H(+)->2H2O (малое ионное уравнение "сокращенное")
Задание 1.
Составьте молекулярное, полное и сокращенное ионное уравнения для реакций между: гидроксидом калия и бромидом меди(II).
Задание 2.
Между какими веществами реакции ионного обмена протекают до конца (ответ поясните: а гидроксидом натрия и хлоридом меди (II); б карбонатом натрия и соляной кислотой; в хлоридом кальция и хлоридом меди (II); г сульфатом бария и карбюонатом натрия?
1)$$ Ca(OH)_2 + CuCl_2 = CaCl_2 + Cu(OH)_2 $$ - реакция идет до конца, так как выпадает осадок
1)
2) a) 2NaOH + CuCl2 = 2NaCl + Cu(OH)2 (осадок
2Na(+)+ 2OH(-) + Cu(2+) + 2Cl (-)= 2Na(+)+ 2Cl(-) + Cu(OH)2 (осадок
2OH(-)+ Cu (2+) = Cu(OH)2
b) Na2Co3 + 2HCl= 2NaCl + H2Co3
2Na(+)+Co3(2-)+ 2H(+)+ 2Cl(-)= 2Na(+)+2Cl(-)+ H2O+ Co2(газ(стрелочка вверх
Co3(2-)+ 2H(+)=H2O + Co2
с CaCl + CuCl2= обратимая реакция, єто 2 противоположніе стрелочки
в 2BaSO4+ 2NaCo3= 2BaCO3 (осадок+ Na2SO4
2BaSo4+ 2Na(+)+ 2CO3(2-)= 2BaCO3(осадок+ 2Na(+) + SO4(2-)
Далее Только Na сокращается, и происходит реакция замещения.
2BaSO4+ 2CO3(2-)= 2BaCO3(осадок+ 2So4(2-)
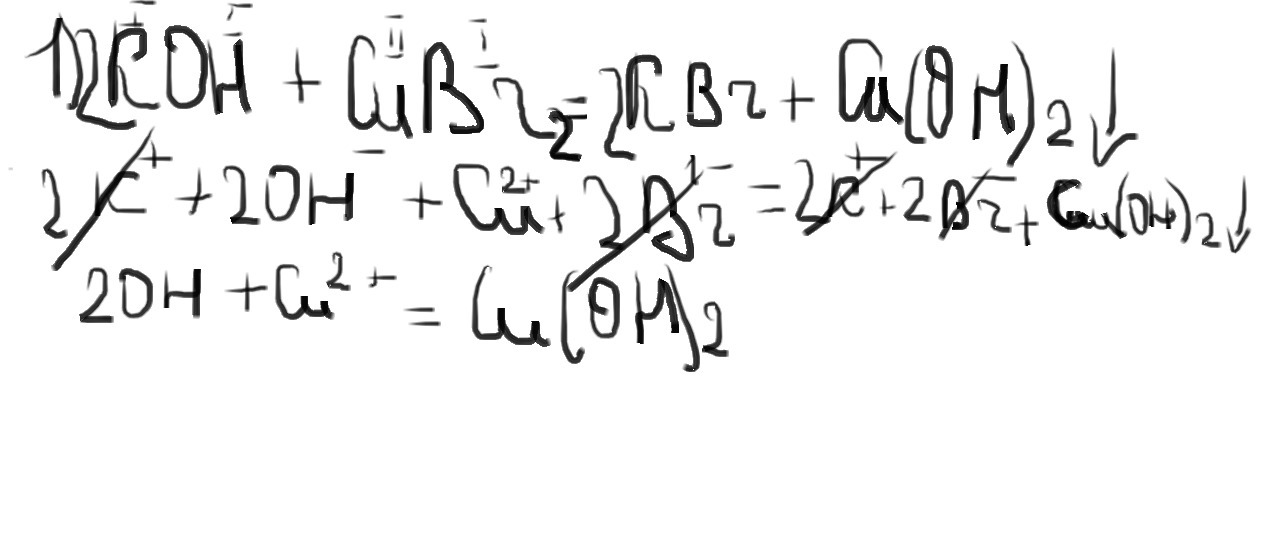
1. Составьте электронную схему атома, электронную и графическую формулу для химического элемента с порядковым номером 19, с помощью которой дайте ответы на следующие вопросы:
1) положение в периодической системе (период, группа, подгруппа.
2 ) количество электронов на внешнем энергетическом уровне.
3) высшая степень окисления, формула высшего оксида, его характер и название.
2. Составить уравнения химических реакций и показать их как окислительно - восстановительные.
А Ba + H2O → Б Al + Fe2O3 →
3. Расставить коэффициенты в схеме реакции методом электронного баланса:
Cu + HNO3 → Cu(NO3)2 + NO + H2O
4. Составить уравнения химических реакций и показать их как реакции ионного обмена:
1) Cu(OH)2 + HNO3 → 2) NaCl + AgNO3 →
5. Осуществить следующие превращения: Fe → FeCl2 → Fe(OH)2 → FeO → FeSO4
Задача. Какой объём водорода выделится, если 10 г. Натрия поместить в воду массой 7,2 г.
N19 K-калий
2е8е8е1е 1s22s2p63s2p64s1
а3 большой период, 1 группа, главная подгруппа.
б 1е
в +1 K2O-оксид калия, основный
г KOH-гидроксид калия, основание
дK более сильный восстановить, чем кальций
2)
аBa+2H2O = Ba(OH)2+H2
б2Al+V2O5 = Al2O3+2V
3)3 Cu+8HNO3 = 3Cu(NO3)2+2NO+4H2O
4) Cu(OH)2+2HNO3 = Cu(NO3)2+2H2O
NaCl+AgNO3 = AgCl+NaNO3
5) Fe+2HCl = FeCL2+H2
FeCL2+2NaOH = Fe(OH)2+2NaCL
Fe(OH)2 = FeO+H2O
FeO+H2SO4 = FeSO4+H2O
Задание1: написать реакции ионного обмена для следующих пар веществ
А нитрат серебра и хлорид калия
Б гидроксид натрия и соляная кислота
В сульфат цинка и гидроксид калия
Г хлорид бария и сульфат натрия
Д сульфид железа (II) и серная кислота
Задание 2. Сколько г осадка выпадет при взаимодействии 13,5 г хлорида
меди (II) с гидроксидом натрия?
1) AgNO3 + KCl = AgCl + KNO3
Ag(+) + NO3(-) + K(+) + Cl(-) = AgCl + K(+) + NO3(-)
Ag(+) + Cl(-) = AgCl
NaOH + HCl = NaCl + H2O
Na(+) + OH(-) + H(+) + Cl(-) = Na(+) + Cl(-) + H2O
H(+)+ OH(-) = H2O
ZnSO4 + 2KOH = Zn(OH)2 + K2SO4
Zn(+2) + SO4(-2) + 2K(+) + 2OH(-) = Zn(OH)2 + 2K(+) + SO4(-2)
Zn(+2) + 2OH(-) = Zn(OH)2
BaCl2 + Na2SO4 = BaSO4 + 2NaCl
Ba(+2) + 2Cl(-) + 2Na(+) + SO4(-2) = BaSO4 + 2Na(+) + 2Cl(-)
Ba(+2) + SO4(-2) = BaSO4
FeS + H2SO4 = FeSO4 + H2S
FeS + 2H(+) + SO4(-2) = Fe(+2) + SO4(-2) + H2S
FeS + 2H(+) = Fe(+2) + H2S
2) 13,5 г Х г
CuCl2 + 2NaOH = Cu(OH)2 + 2NaCl
n = 1 моль n = 1 моль
Mr = 133,5 г/моль Mr = 97,5 г/моль
m = 133,5 г m = 97,5 г
13,5 г CuCl2 - Х г Cu(OH)2
133,5 г CuCl2 - 97,5 г Cu(OH)2
m(Cu(OH)2) = 13,5 * 97,5 / 133,5 = 10 г
Между какими веществами реакции ионного обмена протекают до конца (ответ поясните:
А. Хлоридом натрия и гидроксидом калия;
Б. Карбонатом калия и азотной кислотой;
В. Гидроксидом кальция и хлоридом меди (II);
Г. Сульфатом бария и силикатом натрия.
А NaCl + KOH - реакция не протекает до конца, ИЗ-ЗА ТОГО ЧТО НЕ ВЫПАДАЕТ ОСАДОК, не выделяется газ, не образуется малодиссоциирующее вещество (т. Е не выполняется ни одно условие ионного обмена
б K2CO3 + 2HNO3 = 2KNO3 + CO2 +H2O - реакция идет до конца, так как выделяется газ
в Ca(OH)2 + CuCl2 = CaCl2 + Cu(OH)2 - реакция идет до конца, так как выпадает осадок
г BaSO4 + Na2SiO3 - реакция ионного обмена невозможна, так как сульфат бария - нерастворимая соль.