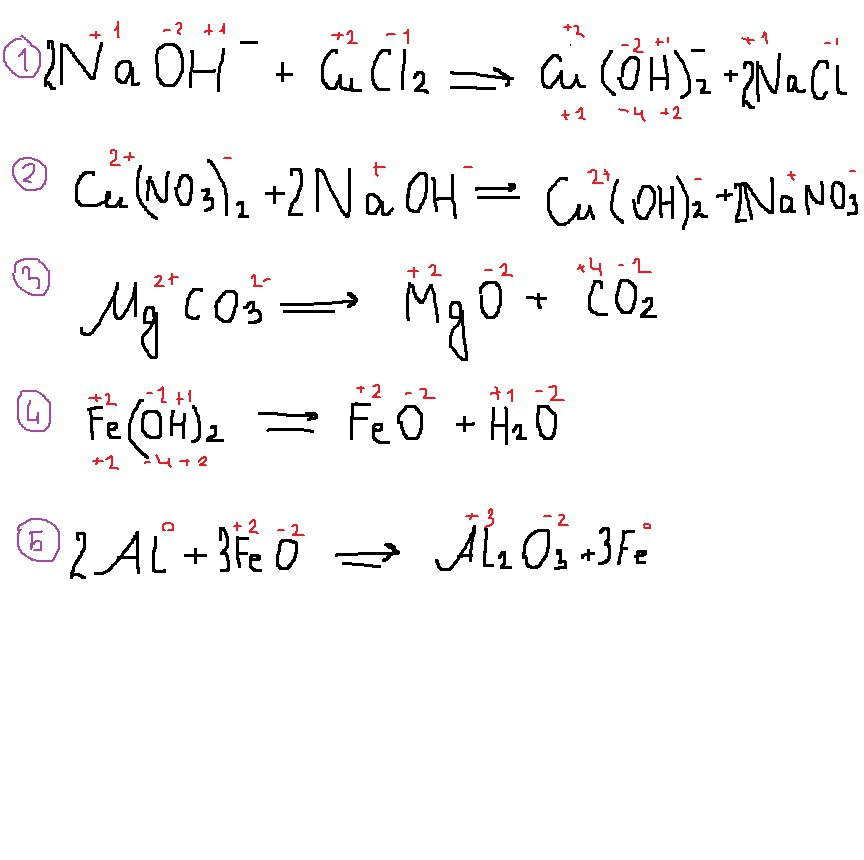Реакции замещения - задачи и примеры
Как расставляются индексы после уравнения реакции? Например: "Сумма коэффициентов между алюминием и соляной кислотой равна=?
Для начала, пишем какие элементы участвуют- Аl+HCl.
Написали. А дальше как? По сути, реакция замещения, следовательно,
Аl+HCl= AlCl + H. Ну и что? Какие тут коэффициенты? Их же тут вовсе нет. Что я упустила?
Ты реакцию правильно написала:
AL+HCL = ALCL+H2(2-потому, что это водород и мы не можем просто поставить H, ну я это не обьясню
дальше, у AL степень окисления равна +3
у H*(это плюс 1), а у Cl`(-1степень окисления )
потом уравновешиваем
AL+2ALCL(2- коэффициент + H2
Степень окисления какого элемента изменилась с -2 до +2 в реакции образования гидроксида меди и хлорида натрия из гидроксида натрия и хлорида меди:
1 Водород
2 Медь
3 Кислород
4 Это не окислительно-восстановительная реакция
Образование гидроксида меди и нитрата натрия из нитрата меди и гидроксида натрия - это реакция:
1 Соединения
2 Разложения
3 Обмена
4 Замещения
Образование оксида магния и углекислого газа из карбоната магния - это реакция:
1 Соединения
2 Разложения
3 Обмена
4 Замещения
Степень окисления какого элемента изменилась с +2 до 0 в реакции образования оксида железа и воды из гидроксида железа:
1 Железо
2 Кислород
3 Водород
4 Это не окислительно-восстановительная реакция
Степень окисления какого элемента изменилась с +2 до 0 в реакции образования железа и оксида алюминия из алюминия и оксида железа (II):
1 Алюминия
2 Железа
3 Кислорода
4 Это не окислительно-восстановительная реакция
вложение, там реакции
1. Ответ: 4
2. Ответ: обмена (обменялись составными частями
3. Ответ: разложения ( из одного сложного - два простых
4. Ответ: 4
5. Ответ: 2
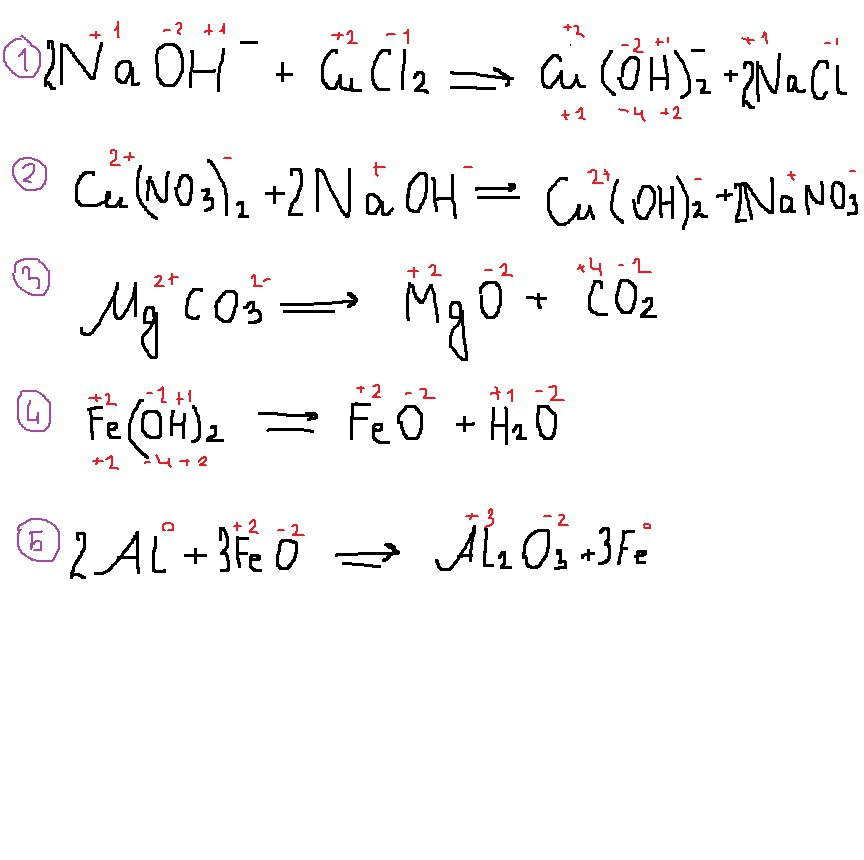
Запишите уравнения реакций соединения, замещения или обмена согласно схемам:
Na₂CO₃⇒CO₂⇒H₂CO₃⇒MgCO₃⇒CO₂
SnCl₂⇒Sn(OH)₂⇒Ca₂SnO₂⇒SnSO₄⇒SnOH⇒SnO
N₂⇒NO⇒NO₂⇒HNO₃⇒Ba(NO₃)₂
Na₂CO₃⇒CO₂⇒H₂CO₃⇒MgCO₃⇒CO₂
Na2CO3 + 2HCl = 2NaCl + H2O + CO2 (обмен
CO2 + H2O = H2CO3 (соединения
H2CO3 + Mg = MgCO3 + H2 (замещения
MgCO3 + t = CO2 + MgO (разложения
SnCl₂⇒Sn(OH)₂⇒Ca₂SnO₂⇒SnSO₄⇒SnOH⇒SnO
SnCl2 + 2NaOH разб = Sn(OH)2 + 2NaCl (обмен
Sn(OH)2 + Ca(OH)2 = CaSnO2 + 2H2O (обмен здесь я вообще если . Не может быть тут два кальция, иначе молекула уже и без олова нейтральна. Быть может вы не так записали
Sn(OH)2 + H2SO4 = SnSO4 + 2H2O (обмен
гидроксида олова 1 нет
SnSO4 + 2NaOH = Sn(OH)2 + Na2SO4 (обмен
Sn(OH)2 + t = SnO + H2O (разложения
N₂⇒NO⇒NO₂⇒HNO₃⇒Ba(NO₃)₂
N2 + O2 (t/p/Pt/MnO2) = 2NO (соединения
2NO + O2 = 2NO2 (соединения
2NO2 + H2O = HNO2 + HNO3 (обмен
2HNO3 + BaO = Ba(NO3)2 + H2O (обмен
Типы реакций
1) Составьте уравнения реакций соединения.
а алюминий + кислород → ….
б железо + ….→ сульфид железа (II)
в магний + ….→ нитрид магния
г оксид…. + оксид фосфора (V)→ фосфат кальция
2) Составьте уравнения реакций замещения.
а ….+ серная кислота → сульфат магния + ….
б ….+ вода→ гидроксид лития + ….
в железо + ….→ сульфат железа (II)+ медь
г цинк + нитрат ртути (II) → ….+….
3) Составьте уравнения реакций обмена.
а сульфид магния + соляная кислота → ….+….
б гидроксид магния + ….→ нитрат магния + вода
в хлорид алюминия + гидроксид натрия → ….+….
г сульфат калия + нитрат бария→ ….+….
Задание №1.
А. 4Al + 3O₂ = 2Al₂O₃
Б. 2Fe + O₂ = 2FeO
В. 3Mg + N₂ = Mg₃N₂
Г. 3CaO + P₂O₅ = Ca₃(PO₄)₂
Задание №2.
А. Mg + H₂SO₄(разб. ) = MgSO₄ + H₂↑
Б. 2Li + 2H₂O = 2LiOH + H₂↑
В. Fe + CuSO₄(разб. ) = FeSO₄ + Cu↓
Г. Zn + Hg(NO₃)₂ = Hg + Zn(NO₃)₂
Задание №3.
А. MgS + 2HCl = MgCl₂ + H₂S
Б. Mg(OH)₂ + HNO₃ = MgNO₃ + 2H₂O
В. AlCl₃ + 3NaOH = 3NaCl + Al(OH)₃
Г. K₂SO₄ + Ba(NO₃)₂ = 2KNO₃ + BaSO₄
1. В ряду химических элементов B-C-N
1) увеличивается заряд атомов
2) возрастают кислотные свойства образуемых гидроксидов
3) увеличивается число эл. Уровней
4) уменьшается электроотрицательность
5) возрастает атомный радиус
2. Для этилена верны след. Утверждения
1) относится к непредельным углеводородам
2) не реагирует с кислородом
3) реагирует с водородом
4) имеет только одинарные связи
5) вступает в реакции замещения
1. 1,2
2. 1,3
1. В ряду химических элементов B-C-N1) увеличивается заряд атомов
2) возрастают кислотные свойства образуемых гидроксидов
2. Для этилена верны след. Утверждения
1) относится к непредельным углеводородам
3) реагирует с водородом
Дописать уравнения реакций, расставить коэффициенты, назвать сложные вещества. А Реакция соединения: B+ O2 → б ) Реакция соединения: Al +N2→ в Реакция замещения: FeO + Al → г ) Реакция обмена Al2 O3 + НСl → 3. По уравнению реакции K + O2 → K2O, вычислите массу оксида калия, если в реакцию с кислородом вступило 15,6 г калия. 4. Какими признаками сопровождаются химические реакции?
Решение:
а 4B+3O₂=2B₂O₃
б 2Al+N₂=2AlN
в 3FeO+2Al = Al₂O₃+3Fe
г Al₂O₃+6HCl = 2AlCl₃+3H₂O
Задача №3
4K+O₂=2K₂O
Найдем количество вещества калия:
$$ m(K_2O)=n(K_2O)*M(K_2O)=0,2*94 = 18,8 $$ г
Ответ: 18,8 г
№4
Химические реакции сопровождаются выделением газа, осадка или слабого электролита, а также в некоторых случаях тепло и свет
Реакции замещения и обмена
а PbCl2 + Al(NO3)3, б PbCl2 + Mgso4, в PbCl2 + Cu(NO3)2
Реакция замещения идёт в б
Правильный ответ а, т.к алюминий как более активный замещает плюмбум, а хлор и NO3 меняются без изменения степеней окисления
Реакция замещения, как получить?
Реакции замещения могут происходить в виде двойного обмена: А—В + С—Е А—С + В—Е. Один из подвидов — вытеснение, например, меди железом из раствора медного купороса: CuSO4 + Fe = FeSO4 + Cu. В качестве «атакующей» частицы могут выступать атомы, ионы или функциональные группы
Данные химические реакции распределите по реакция соединения, разложения, обмена и замещения; уравняйте, подпишите названия исходных веществ и продуктов реакций.
1) Fe + CuCl2 → FeCl2 + Cu
1) N2 + O2 → NO
2) Mg + O2 → MgO
2) Mg + HCl → MgCl2 + H2↑
3) CuO + H2SO4 → H2O + Cu SO4
3) Na2SO3 + HCl → NaCl + H2O + SO2↑
4) KClO3 → KCl + O2 ↑
4) SiO2 + Mg → MgO + Si
5) Cu(OH)2 → CuO + H2O
5) KOH + H2SO4 → K2SO4 + H2O
6) HCl + AgNO3 → AgCl ↓ + HNO3
6) NaNO3 → NaNO2 + O2 ↑
1) Fe + CuCl2 → FeCl2 (соль хлорид железа (II) + Cu (металл - медь - реакция замещения
1) N2 + O2 → 2NO (оксид азота (II) - реакция соединения
2)2Mg + O2 → 2MgO (оксид магния (II) - реакция соединения
2) Mg + 2HCl → MgCl2 (соль хлорид меди (II) + H2↑(газ - выделяется водород - реакция замещения
3) CuO + H2SO4 → H2O (вода+ Cu SO4 (соль - сульфат меди реакция обмена
3) Na2SO3 + 2HCl → 2NaCl (соль хлорид натрия+ H2O (вода + SO2↑(оксид серы (IV) - реакция ионного обмена
4)2KClO3 →2KCl (соль хлорид калия + 3O2 ↑ (выделение кислорода (реакция разложения
4) SiO2 + 2Mg → 2MgO(оксид магния + Si(неметалл - кремний реакция замещения
5) Cu(OH)2 → CuO (оксид меди(II)+ H2O (вода - реакция разложения
5) 2KOH + H2SO4 → K2SO4(соль - сульфат калия + 2H2O (вода - реакция ионного обмена
6) HCl + AgNO3 → AgCl ↓ (соль хлорид серебра+ HNO3(азотная кислота - реакция ионного обмена
6) 2NaNO3 → 2NaNO2(соль нитрит натрия + O2 ↑ выделение газа - кислорода - реакция разложения
Подскажите, как определить реакцию разложения, соеденения, обмена, замещения и т.д.
По этой схеме будет понятно
Реакции разложения - это реакции, при которых от одной молекулы сложного вещества отщепляются несколько простых веществ или сложных.
Примеры:
SO2->S+O2
2H3PO4->P2O5+3H2O
4HNO3->4NO2+2H2O+O2
2C6H2(NO2)3OH->3C+6CO+3CO2+3N2+H2+2H2O
Реакции соединения - реакции, практически идентичные реакциям разложения, только протекающие в обратную сторону. Примеры:
SO3+H2O->H2SO4
2Mg+O2->2MgO
4NO2+2H2O+O2->4HNO3
Реакции замещения - это реакции, при которых один атом (остаток того либо иного вещества замещает другой. Примеры:
Zn+CuSO4->ZnSO4+Cu
Mg+2HCl->MgCl2+H2
2Na+2H2O->2NaOH+H2
Ну и реакции обмена, наконец, это реакции, при которых вещества обмениваются теми или иными хим. Остатками. Примеры:
Ba(OH)2+MgSO4->BaSO4+Mg(OH)2
NaHCO3+HCl->NaCl+CO2+H2O
2NaOH+H2SO4->Na2SO4+2H2O