1. В молекуле азота N2 химическая связь:
а) ионная, б) ковалентная неполярная, в) ковалентная полярная, г водородная.
2. В каком ряду записаны вещества только с ионной связью:
а SO2, CaO, K2SO4; б H2S, AlCl3, NaI; в CO, C2H2, Cs2O, г CaO, BaI2, Li2O.
3. Число б-связей в молекуле этина:
а 5, б 4, в 3, г 6.
4. Вещество между молекулами которого существует водородная связь:
а Этанол, б метан, в водород, г бензол.
5. Наибольшая степень окисления серы в соединении:
а KHSO3, б Na2S, в H2SO4, г S8.
1. В молекуле азота N2 химическая связь: б ковалентная неполярная,
2. В каком ряду записаны вещества только с ионной связью:
г CaO, BaI2, Li2O.
3. Число б-связей в молекуле этина:
в 3
4. Вещество между молекулами которого существует водородная связь:
а Этанол
5. Наибольшая степень окисления серы в соединении:
в H2SO4
1. Степень окисления серы в соединении MgSO4
2. Сумма атомов в молекуле фосфата натрия
3.
4. Класс вещества, формула которого состоит из 1 атома водорода, 1 атома азота, 3 атомов кислорода.
5. Число соединений с ионной химической связью в ряду веществ NO, O2, Nal, H2S, N2, MgF2
6. Количество электронов на внешнем энергическом уровне атома натрия
7. Сумма коэффициентов в сокращенном ионном уравнении оксида меди (II) с соляной кислотой
8. Тип химической реакции Zn+CuCl2 = ZnCl2+Cu
9. Вычислить массу образовавшийся меди, если известно, что цинка дано 195г. Расчет производить по уравнению химической реакции задания #8
1)+6
2) Na3PO4-8
3)-
4) HNO3- класс гидроксиды, кислота(азотная
5) NaI,MgF2 - 2
6)1
7) CuO+2H(+)=Cu(2+)+H2O - 5
8) Реакция замещения
9) n(Zn)=m(Zn) Mr(Zn)=19565 = 3 моль
n(Cu)=n(Zn)=3 моль
m(Cu)=n(Cu)*M(Cu)=3*64 = 192 г
Ответ:192 г
1) +6
2) Na3PO4 ( 3+1+4 = 8)
3)
4) HNO3 - кислота
5) 2 (NaI, MgF2)
6) 1
7) CuO + 2H+ = Cu (2+) + H2O (1+2+1+1 = 5)
8) замещение
9) M(Zn) = 65 г/моль, M(Cu) = 64 г/моль
Составим пропорцию:
65 - 64
195 - х
х =192 г
масса образовавшейся меди - 192 г
Вещество в котором степень окисления серы равна -2 имеет формулу?
H₂S у водорода +1 у серы -2
Степень окисления кислорода равна −2 во всех соединениях, где кислород не образует простой ковалентной связи O—O, т.е. В подавляющем большинстве соединений — оксидах. Так, степень окисления кислорода равна −2 в H2O, H2SO4, NO, CO2 и CH3OH; но в пероксиде водорода, H2O2 (HO—OH), она равна −1 (другими исключениями из правила, согласно которому кислород имеет степень окисления −2,
. В соединениях неметаллов, не включающих водород и кислород, неметалл с большей электроотрицательностьюсчитается отрицательно заряжённым. Степень окисления такого неметалла полагается равной заряду его наиболее распространённого отрицательного иона. Например, в CCl4 степень окисления хлора −1, а углерода +4. В CH4 степень окисления водорода +1, а углерода −4. В SF6 степень окисления фтора −1, а серы +6, но в CS2 степень окисления серы −2, а степень окисления углерода +4
П1. Распределение электронов в атоме кремния:
а 2,8, 3; б 2,8, 4; в 2,4; г 2,8, 18,4.
2. Распределение электронов в атоме калия:
а 2,8, 8,1; б 2,8, 1; в 2,8, 18,1; г2,1
3. Степени окисления хлора в соединениях HClO и KClO3 соответственно равны: а +2 и+3; б +1 и +7; в+1 и +5; г +3 и +5.
8. Вещество, в котором степень окисления серы равна-2, имеет формулу: а SO3; бSO2; в Al2S3; гK2SO4.
Ответы: ↓ ↓ ↓ ↓
1. Б
2. А
3. В
4. В
Из комментария:
1. А
2. В
3. В
1. Б 2,8,4;
2. А 2,8,8,1;
3. Степени окисления хлора в соединениях HCl⁺¹O и KCl⁺⁵O3 соответственно равны: в+1 и +5;
8. Вещество, в котором степень окисления серы равна-2, имеет формулу:; в Al₂S₃⁻²;
I. Даны формулы веществ: а AgNO3; б HNO3; в NaCl; c) H2SO4; д MgO; e) NaOH; ж N2O5; з Mg(OH)2; и SO2 Ответьте на предложенные ниже вопросы, выбрав правильный ответ под соответствующими буквами: 1. Выберите основания. 2. Найдите щелочь. 3. Определите двухосновные кислоты. 4. Напишите формулу кислоты, соответствующей веществу “и”. 5. Найдите вещество, в котором степень окисления серы равна +6. 6. Определите оксиды неметаллов. 7. Выберите формулу соли и назовите ее. 8. Определите степени окисления атомов в соединении “з”. 9. Определите заряды ионов в веществе “з”. 10. Выберите формулу оксида и кислоты, соответствующие друг другу.
1. Е, з
2. Е
3. С
4. Какой кислоты? А так тут 2 кислоты: с, б
1. Mg(OH)2
2. NaOH
3. H2SO4
4. H2SO3
5. H2SO4
6. N2O5, SO2
7. AgNO3-нитрат серебра
NaCI-хлорид натрия
8. Mg(+2), O(-2), H(+1)
9. Mg(2+), OH(-)
10. N2O5->HNO3
Определите степень окисления серы в алюминия сульфат AI2(SO4)3
A)+2 B)+6 C)-4 D)+3
Молекула всегда электронейтральна, поэтому алгебраическая сумма всех степеней окисления в молекуле равна нулю.
Al₂⁺³(S⁺⁶O₄⁻²)₃
Примем степень окисления серы за х,
2*(+3)+[x+4*(-2)]*3 = 6+[x-8]*3 = 6+3x-24 =0
3x = 18
x=(+6)
Проверим правильность написания степеней окисления
2*(+3)+[1*(+6)+4*(-2)]*3 = 6+[6-8]*3 = 6+18-24 = 0
Cтепень окисления серы = +6
Ответ: В +6
1. Составьте химические формулы соединений: аоксид натрия; бсерная кислота; внитрат кальция; ггидроксид алюминия; дфосфат железа 2.
2. Назовите соединения: HNO2, P2O5, Ba(OH)2, K2SO4, H2SO4.
3. Напишите формулы оксидов, которые соответствуют гидроксидам: H2SO3, KOH, Fe(OH)3, H3PO4, Ba(OH)2.
4. Определите степень окисления серы в соединениях: SO2, SO3, H2S, CaS, H2SO4.
5. Рассчитайте объем азота, полученного их 150 л воздуха (Объемную долю азота в воздухе примите за 78%).
6. К 40 кг 30% раствора соли добавили ещё 20 кг соли. Определите массовую долю соли в полученном при этом растворе.
1) аNa₂O, б H₂SO₄, вCa(NO₃)₂, гAl(OH)₃, дFe₃(PO₄)₂
2) HNO₂ - азотистая кислота, P₂O₅ - окисид фосфора(V), Ba(OH)₂ - гидроксид бария, K₂SO₄ - сульфат калия, H₂SO₄ - серная кислота.
3) SO₂ - оксид серы(IV), K₂O - оксид калия, Fe₂O₃ - оксид железа (III), P₂O₅ - оксид фосфора(V), BaO - оксид бария.
4) S⁺⁴O₂, S⁺⁶O₃, H₂S⁻², CaS⁻², H₂S⁺⁶O₄.
5) V(N₂)=150*0.78 = 117л
6) m(соли1)=40*0.3 = 12кг - масса соли в исходном растворе
m(р-ра2)=40+20 = 60кг - масса раствора после добавления соли
m(соли2)=12+20 = 32кг - общая масса соли в полученном растворе
W(соли = 32/60 = 0.533 (53.3%)
Степень окисления серы в FeSO3
распишите
У железа над формулой +2, это можно посмотреть по таблице. Под формулой сносим тоже +2, т.к никаких индексов нет
У кислорода над формулой -2(постоянная), искл. Соединения со фтором. Под формулой -6, т.к. Есть индекс 3 (-2*3=-6)
И так, под формулой +2 и -6, к -6 прибавляем 2 и получаем -4, но нам нужно, чтобы под формулой в сумме получился 0, поэтому меняем знак на противоположный. Теперь под серой +4 и поднимаем это число наверх и получаем, что у серы степень окисления +4( если будет индекс), то нужно будет на него разделить
Ответ: +4
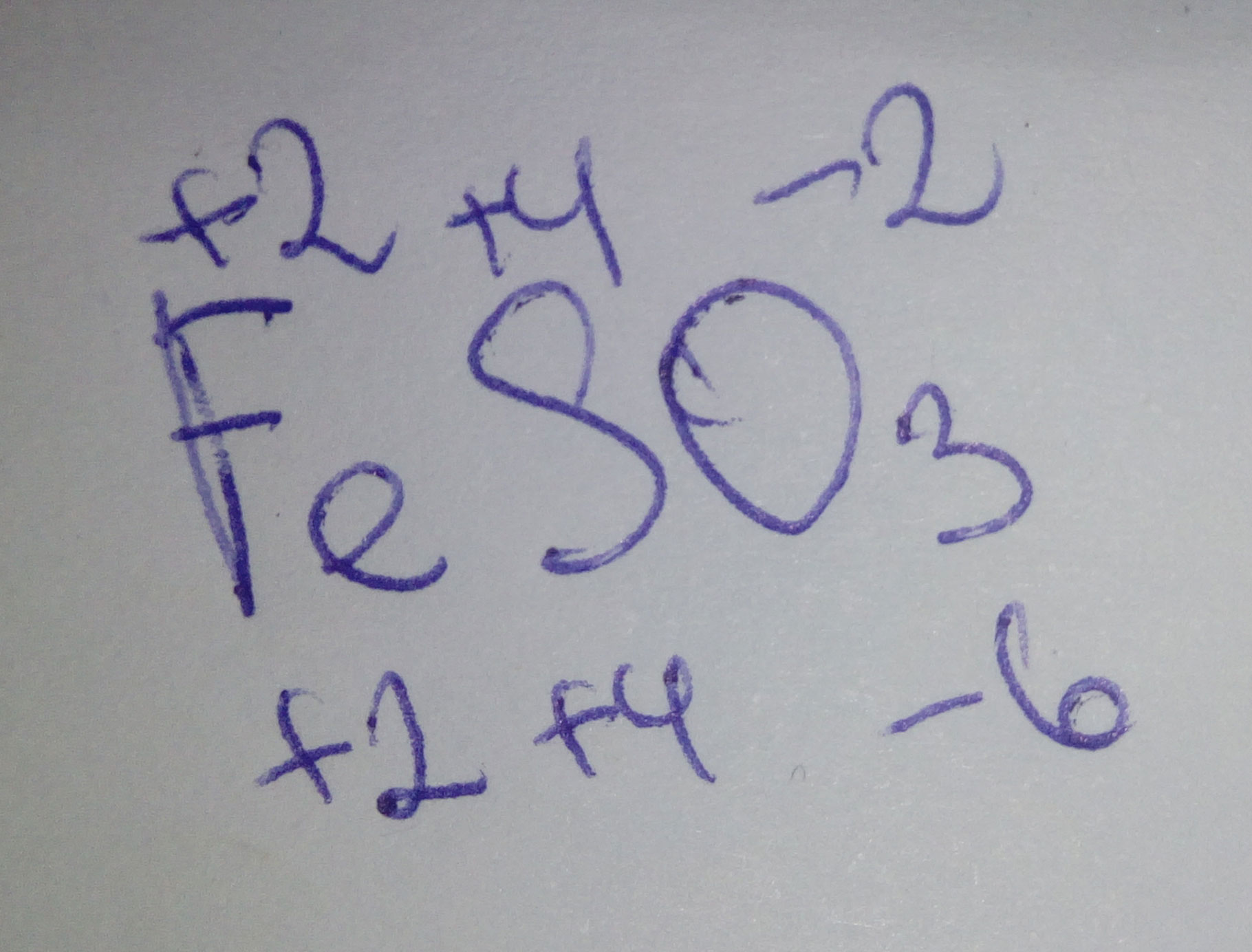
Степень окисления серы в соединении caso4, so2, h2so4 соответственно равна
1) +4, +6, +6
2) +6, +4, +6
3) +6, +6, +4
4) +6,2, +4
2) +6, +4, +6
В серной кислоте сера находится в своей высшей степени окисления - +6, а значит, такая же степень окисления будет у нее и в сульфатах. В SO2 же степень окисления серы легко вычисляется:
х+2*(-2)=0 (молекула электронейтральна, степень окисления кислорода постоянная и равна -2)
х-4 = 0
х=4
CaS⁺⁶O₄
S⁺⁴O₂
H₂S⁺⁶O₄
Ответ: 2) +6, +4, +6
1. Определите степени окисления атомов элементов в веществах которых: Mg₃P₂; SO₃; CaS; V₂O₅; AlCl₃.
2. Составьте формулы бинарных соединений из химических элементов, атомы которых имеют следующие степени окисления: Mg⁺²и H⁻¹; Fe⁺³ и O⁻²; S⁺⁶и F⁻¹. Назовите вещества.
3. Для лечения некоторых заболеваний используют природные минеральные воды, в состав которых входят сероводород и сернистый газ (SO₂). Определите валентность и степень окисления серы в этих соединениях. Приведите их формулы.
1) Mg₃⁺²P₂⁻³; S⁺⁶O₃⁻²; Ca⁺²S⁻²; V₂⁺⁵O₅⁻²; Al⁺³Cl₃⁻¹
2) Mg⁺²H₂⁻¹ - гидрид магния;
Fe₂⁺³O₃⁻² - оксид железа (III);
S⁺⁶F₆⁻¹ - фторид серы (VI).
3)
I II
H₂S⁻²
IV II
S⁺⁴O₂