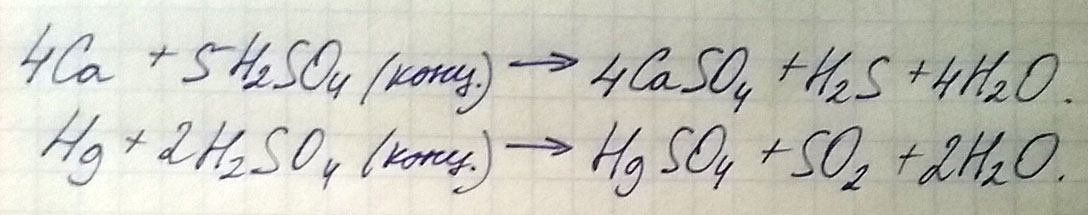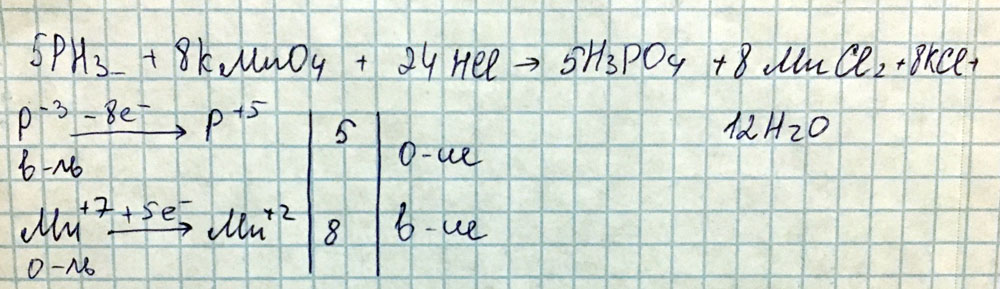Расставить коэффициенты методом электронного баланса - задачи и примеры
Составьте уравнения реакции взаимодействия:
аZn + S= (укажите степени окисления и расставьте коэффициенты методом электронного баланса
б F₂ + S =
в Ba(NO₃)₂ + H₂SO₄= (в молекулярной и ионной формах
г H₂SO₄ + Na =
Zn⁰ + S⁰ = Zn⁺²S⁻²
Zn⁰ - 2e⁻ = Zn²⁺ | 1 - восстановитель, процесс окисления
S⁰ + 2e⁻ = S²⁻ | 1 - окислитель, процесс восстановления
3F₂⁰ + 6S⁰ = S⁺⁶F₆⁻
3F₂⁰ + 6 e⁻ = 6F⁻ | 1 - окислитель, процесс восстановления
S⁰ - 6 e⁻ = S⁶⁺ | 1 - восстановитель, процесс окисления
Ва(NO₃)₂ + H₂SO₄ = BaSO₄↓ + 2HNO₃
Ba²⁺ + 2NO₃⁻ + 2H⁺ + SO₄²⁻ = BaSO₄↓ + 2H⁺ + SO₄²⁻
Ba²⁺ + SO₄²⁻ = BaSO₄↓
H₂SO₄ + 2Na = Na₂SO₄ + H₂
3) Определите роль хрома в окислительно - восстановительном процессе:
CrO3 + H2S -> Cr2(SO4)3 + S + H2O
Расставьте коэффициенты методом электронного баланса.
4) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а Cr -> CrCl3 -> Cr(OH)3 -> Cr(No3)3
|
K[Cr(OH)4]
b) Cr2(SO4)3 -> Cr(OH)3 -> Cr2O3 -> Cr -> Cr2S3.
c) Cr2(So4)3 -> K2Cr2O7 -> K2CrO4-> BaCrO4
2CrO3+6H2S = Cr2(SO4)3+3S+6H2O Cr6+- +3e-Cr3+ Окисл. 2 S2-2e-So восст. 3 Кислород не уравнивается, где-то ошибка 4) а 1)-4Сr+3Cl2 = 2CrCl3 2)-CrCl3+3NaOH = Cr(OH)3+3NaCl 3)-Cr(OH)3+3HNO3 = Cr(NO3)3+3H2O бCr2(SO4)3+6NaOH = 2Cr(OH)3+3Na2SO4 2Cr(OH)3 = Cr2O3+3H2O Cr2O3+3H2 = 2Cr+3H2O 2Cr+3S = Cr2S3 C)-
1. Составьте уравнения реакций взаимодействия: а алюминия с серой; б железа с раствором соляной кислоты; в натрия с бромом. В уравнении реакции (а расставьте коэффициенты методом электронного баланса.
А2Al+3S = Al2S3
\( S^{-2} ║3 \)
БFe+2HCl = FeCl2+H2
В2Na+Br2 = 2NaBr
на примере первого баланса остальные...
1) Расставьте степени окисления химических элементов в соединениях:
MgCl2, S, H2SO3, CaO, Na2s, SO2, SO3, NH3, Cr2O3, FE, CrO3, HCL, K3P, FE2O3, CaBr2, AL2S3, FEO, HF, H2, MN2O7, P2O3, H3PO4, Na2SO4, KNO3
2) Водород в лаборатории получают при действии кислот на некоторые металлы. При этом атомы водорода в кислотах замещаются атомами металлов. Напишите уравнения взаимодействия сероводородной ( H2S) и фосфорной ( H3PO4) кислот с натрием и магнием.
3) расставьте коэффициенты методом электронного баланса в приведенных схемах реакций
а H2+O2 = H20
б K+Cl2 = KCl
в Fe+CUCl2= FeCl+Cu
4) Какой объем водорода (в литрах прореагирует с 14г азота N2 (н.у.)?
5) Составьте формулы бинарных соединений:
а серы (+6) и кислорода
б цинка и хлора
в фосфора (-3) и водорода
г меди (+2) и брома.
ЗАДАНИЕ 1:
Mg(+2) CI2(-1), H2(+1) SO3(-2), Ca(+2) O(-2), Na2(+1) S(-2), S(+4) O2(-2), S(+6) O3(-2), N (+3) H3(-1), Cr2(+3) O3(-2), Cr(+6) O3(-2), H(+1) CI(-1), Fe2 (+3) O3 (-2), Ca(+2) Br2(-1), Al2 (+3) S3 (-2), Fe(+2) O(-2), H(+1) F(-1), Mn2 (+7) O7 (-2), H3(+1) P(+5) O4 (-2), Na2 (+1) S(+4) O4 (-2), K(+1) N(+5) O3( -2), такие вещества как S, Fe и H2 будут иметь 0-ой заряд;
ЗАДАНИЕ 2:
2Na + H2S -> Na2S + H2
Mg + H2S -> MgS + H2
6Na + 2H3PO4 -> 2Na3PO4 + 3H2
3Mn + 2H3PO4 -> Mn3(PO4)2 + 3H2
ЗАДАНИЕ 4:
Дано: m (N2) = 14г найти: V (Н2) =?
Решение:
N2 + 3H2 -> 2NH3 (NH3 – аммиак
ν = 1 моль ν = 3 моль
М = 28г/моль Vm = 22.4л/моль
m = 28г V = 67, 2 л
14/28 = х / 67,2 х = 14 * 67,2 / 28 = 33,6л
Ответ: V (Н2) = 33,6л
ЗАДАНИЕ 5:
a) S (+6) O3 (-2)
b) Zn (+2) CI2 (-1)
c) P (+3) H (-1)
d) Cu (+2) Br2 (-1)
Написать уравнения реакций взаимодействия концентрированной серной кислоты с кальцием и со ртутью.
Расставить коэффициенты методом электронного баланса.
Прости, на электронный нс времени нет, но все уровнял
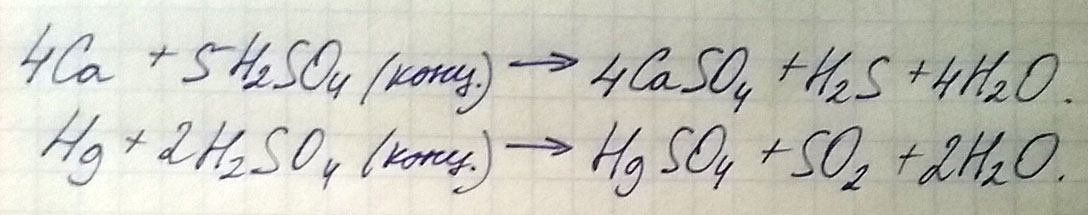
Напишите уравнения реакций и расставьте коэффициенты методом электронного баланса.
Al+KNO3->
Al+NaOH+H2O->
Al+HCl->
Al + KNO3 -> реакция не пойдет
2AL +2 NaOH +6 H2O -> 2Na[Al(OH)4] + 3H2
Al(0) -3e -> Al(+3) 2 ок-ие
в-ль
2H(+) +2e -> H2(0) 3 в-ие
ок-ль
2Al +6HCl -> 2AlCl3 +3 H2
Al(0) -3e -> Al(+3) 2 ок-ие
в-ль
2H(+) +2e -> H2(0) 3 в-ие
ок-ль
1) Составьте уравнение реакции, схема которой Ca+H2SO4(конц. )=.+Н2S+H20/Расставьте коэффициенты методом электронного баланса.
2) К 245 г 10%-ного раствора серной кислоты добавили раствор хлорида бария. Определите массу выпавшего при этом осадка
1) 4Ca+5H2SO4->4CaSO4+H2S+4H2O
Ca(0)+2e- = Ca(+2)
S(+6)-8e- = S(-2)
Правило креста, поэтому 8 перед кальцием и 2 перед серой, но мы можем сократить и поэтому ставим 4 и 1, а если 1 то коэффициенты не нужны. Дальше уравниваем по группировкам SO4 вместе с S в правой части. Потом по H2 и O2
2) m(р-ра h2so4)=245 г
+BaCl2
w(омега = 0,1
Решение:
H2SO4+BaCl2->BaSO4+2HCl, BaSO4 - осадок
w = m(веществаm(раствора => 0,1 = m(BaSO4)245 => m(BaSO4)=0,1*245 = 24,5 г
Расставьте коэффициенты методом электронного баланса укажите окислитель и восстановитель окисление и восстановление PH3+KMnO4+HCI = H3PO4+MnCI2+KCI+ H2O Ps.
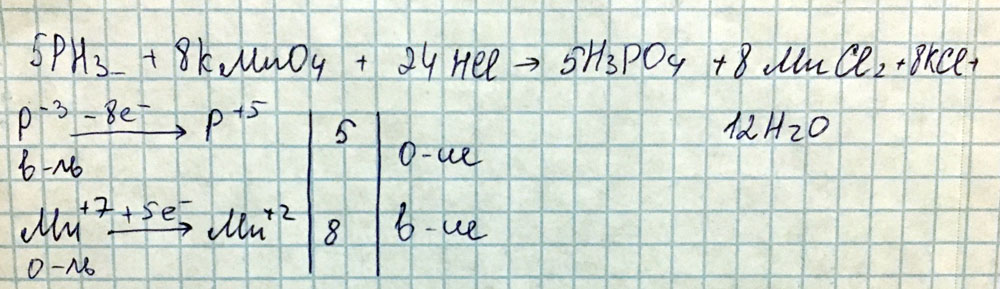
Расставить коэффициенты методом электронного баланса: H2S+SO2 = S+H2O
S(2-) => S(0) + 2e(-) | 2
S(4+) + 4e(-) => S(0) | 1
Суммируем полученные уравнения, домножая на соответствующие коэффициенты:
2S(2-) + S(4+) = 3(S0)
Подставляем и уравниваем оставшиеся ионы
2H2S + SO2 = 3S + 2H2O
Закончите уравнение реакций расставьте коэффициенты методом электронного баланса:
1) Mg + CI2 (стрелочка)
2) Вa + HCI (стрелочка)
Mg + Cl2 = MgCl2
Mg 0 -2e = Mg +2 | | 1 | восстановитель, оксиление
Cl2 0 +2e = 2Cl -1 | 2 | 1 | окислитель, восстановление
Ba + 2HCl = BaCl2 + H2
Ba 0 -2e = Ba +2 | 2 | 1 |восстановитель, окисление
2H +1 +2e = H2 0 | | 1 | окислитель, восстановление