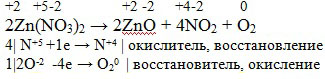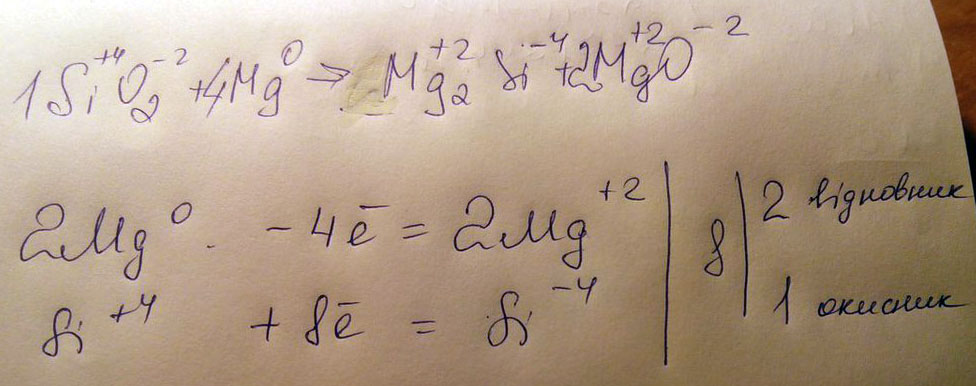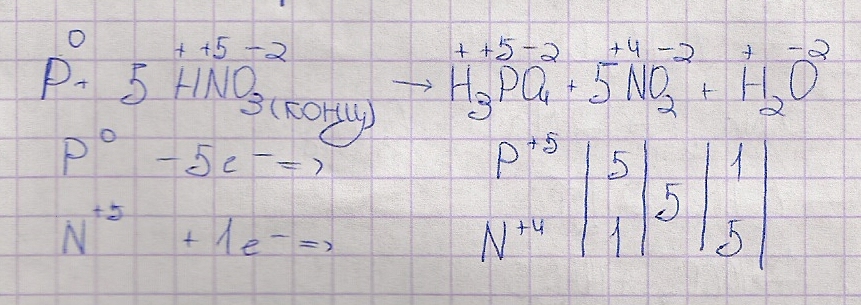Метод электронного баланса - задачи и примеры
Используя метод электронного баланса, расставьте коэффициенты в схемах окислительно - восстановительных реакций:
Cl2+NaOH = NaClO + NaCl + H2O (без нагревания
Cl2+NaOH = NaClO + NaCl + H2O (при нагревании
Без нагревания
Cl₂⁰+2NaOH = NaCl⁺O+NaCl⁻+H₂O
Cl₂⁰-2e⁻ = 2Cl⁺ | 1 - восстановитель, процесс окисления
Cl₂⁰+2e⁻ = 2Cl⁻ | 1 - окислитель, процесс восстановления
с нагреванием
3Cl₂⁰+6NaOH = NaCl⁺⁵O₃+5NaCl⁻+3H₂O
Cl₂⁰-10e⁻ = 2Cl⁵⁺ | 1 - восстановитель, процесс окисления
Cl₂⁰+2e⁻ = 2Cl⁻ | 5 - окислитель, процесс восстановления
Используя метод электронного баланса, составьте уравнение реакции BR2+KI+H2O = KIO3+HBR
Определите окислитель и восстановитель.
3Br₂+KI+3H₂O->KIO₃+6HBr
3Br₂⁰ +K⁺I⁻ +3H₂⁺O²⁻->K⁺I⁵⁺O₃²⁻+6H⁺Br⁻
Br₂⁰+2e⁻ = 2Br⁻| |1
|2|
I⁻+6e⁻ = I⁵⁺ | |3
Br поменял степень окисления на ⁻, то есть прибавил 1 електрон - это окислитель
Соответственно I - восстановитель
Используя метод электронного баланса расставьте коэффициенты, укажите окислитель и восстановитель
Zn(NO3)2 = ZnO+NO2+H2O
Решение данного уравнения в фото
ОВР баланс
только в данной реакции ошибка. В продуктах вода! Откуда взяться водороду, если его в реагентах нет!
при разложении нитрата цинка выделяется оксид цинка, диоксид азота и кислород!
2Zn(NO3)2 = 2ZnO+4NO2+O2
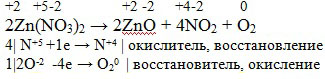
Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
K2MnO4+HCl(конц,)=MnCl2+KCl+Cl2+H2O
Определите окислитель и восстановитель
K2MnО4+HCl(конц⇒МnCl2+KCl+Cl2+H2O
1) записали уравнение и расставляем степень окисл. ( Степень. Окисл будит скобочках, и степ окисл пигшим на верху каждого элемента
К2(+1) Mn(+6) O4(-2)+H(+1) Cl(-1) (конц
⇒Mn(+2) Cl2(-1)+К(+1) Сl(-1)+Cl2(0)+Н2(+1) О(-2)
На заметку; у Н(водорода всегда +1, а у О(кислорода всегда -2. А когда элемент один то есть как здесь Cl2 -то у него нулевая степень.
2) Электрон. Баланс
Mn(+6) + 4e⇒Mn(+2) -окислитель.
Сl(-1)+1e⇒Cl(0)-восстановитель.
3) Теперь расставляем коэффициенты.
К2MnO4+8HCl(конц⇒MnCl2+2HCl+2KCl = 2Cl2+4H2O
. Те цифры какие в скобка их ставить на вверху элемента
C1. Используя метод электронного баланса, составьте уравнение реакции:
Na + H2SO4= Na2SO4+H2↑
Определите окислитель и восстановитель.
Na-восстановитель, т.к у него был заряд 0, а стал +1 H2-окислитель, т. к. Был заряд +1, а стал 0. Перед Na ставим коэффициент 2
2Na+H2SO4 = Na2SO4+H2
Na(0)->Na(+1)(над стрелочкой -1) в-ль 2H(+1)->H2(0)(над стрелочкой +2) о-ль
18. Используя метод электронного баланса, расставьте коэффициенты в
схеме реакции:
SiO2 + Mg –> Mg2Si + MgO
Определите окислитель и восстановитель.
Возможно так;
відновник - восстановитель
окисник- окислитель
SiO2 + 4Mg = Mg2Si + 2MgO
SiO2 +4 -2
Mg 0
Mg2Si +2 -4
MgO +2 -2
Si +4 8e = Si -4e | 8 | 1 | восстановитель, окисление
Mg 0 2e = Mg +2 | | 4| окислитель, восстановление
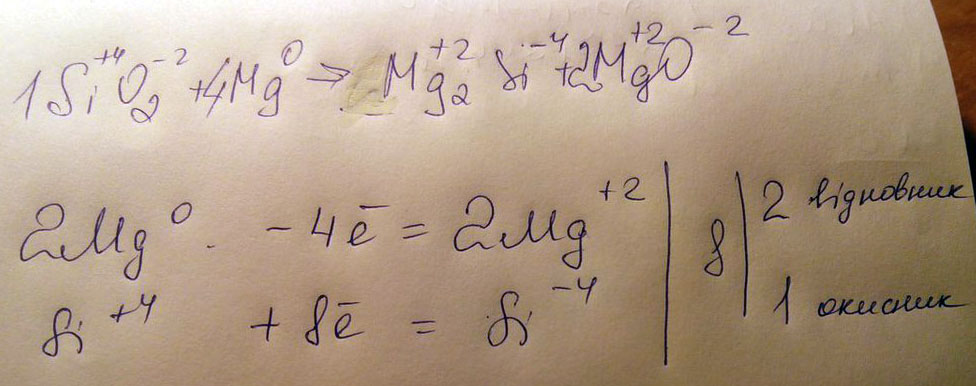
H2O2 + KClO3 → KCl + O2 + H2O
Используя метод электронного баланса, составьте уравнение реакции. Определите окислитель и восстановитель
Запишу уравнение сразу с коэффициентами. Если после элемента стоит шляпка ^и число после неё - это указание степени окисления:
Например, KCl^(+5) O3^(-2)
3H2O2 + KClO3 = KCl + 3O2 + 3 H2O.
2O^(-1) - 2e = 2O^(0) - реакция окисления, кислород - восстановитель.
Cl^(+5) + 6e = Cl^(-1) - реакция восстановления, хлор - окислитель.
Расставьте коэффициенты в реакции, используя метод электронного баланса:
Р + HNO3 (конц. ) = Н3РО4 + NO2 + Н2О
Р + 5HNO3 (конц. ) = Н3РО4 + 5NO2 + Н2О
Восстановление:
NO3 − + 2H+ + 1e− = NO2 + H2O 5
Окисление:
P + 4H2O − 5e− = PO43− + 8H+ 1
5NO3− + 2H+ + P = 5NO2 + H2O + PO4 3−
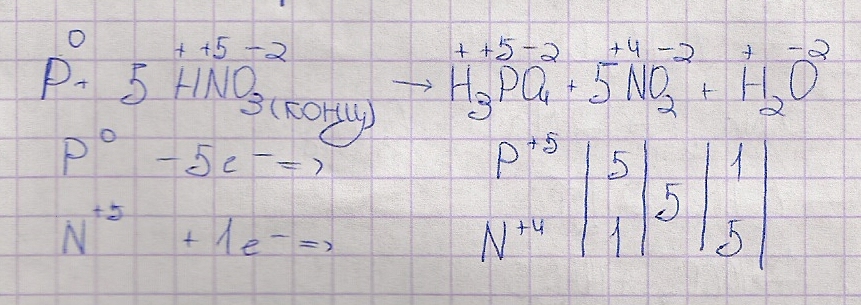
1. Вещество, которое в водном растворе диссоцирует на ионы:
1) (NH4)2SO4;
2) Сa3(PO4)2;
3) CaCO3;
4) CaSiO3;
2. Уравнению химической реакции
H2SO4 + 2NaOH = Na2SO4 + 2H2O
соответствует сокращенное ионное уравнение:
1) H+ + OH - = H2O
2) NAOH = Na+ + OH-
3) H2SO4 = H+ + SO42-
4) HSO4- = H+ + SO42-
4. Степень окисления серы в сернистой кислоте;
1) -2;
2) +6;
3) +4;
4) 0;
4. Сера и кислород по строению атома сходны:
1) зарядом ядра;
2) количеством заполненных энергетических уровней;
3) количеством электронов на внешнем энергетическом уровне;
4) не завершенностью внешнего энергетического уровня.
5. Массовая доля серы в серной кислоте равна:
1) 16,33%;
2) 32,65 %;
3) 39,02 %;
4) 98%.
6. Формула нитрита магния:
1) Mg(NO3)2;
2) Mg(NO2)2;
3) Mg3N2;
4) Mn(NO3)2.
7. Разбавленная серная кислота не взаимодействует с:
1) NaOH;
2) Mg;
3) BaCl2
4) Hg:.
8. Степень окисления -3 азот проявляет в соединении
1) N2О3;
2) HNO3;
3) NF3;
4) NH4Cl
9. Аммиак не вступает во взаимодействие с:
1) кислородом;
2) водородом;
3) соляной кислотой;
4) водой;
10. Оксид серы (IV) способен реагировать с:
1) водой
2) метаном
3) ортофосфорной кислотой
4) сервисным газом
11. Напишите уравнения реакций превращений:
H2-S-A-SO3-NA2SO4 и укажите вещество A
12. При взаимодействии 30 грамм сульфита натрия с раствором соляной кислоты образуется сернистый газ при (н. у.) объемом л?
13. Используя метод электронного баланса и уравнения реакции
H2SO4(КОНЦ+С = SO2+CO2+H2O
Расставьте коэффициенты и укажите окислитель и восстановитель
10 вопрос1
8 вопрос 4
7 вопрос )4
6 вопрос2
четвертый 3
1-1
2-1
3-3
4-3
5-
6-2
7-
8-4
9-
10-
11-
12-5,3л
13 2H2SO4+C = 2SO2+CO2+2H2O
S+6 ->+2e->S+4 это окислитель
C0->-4e->C+4 это восстановитель
Метод электронного баланса
1.C+O2 = CO
2.2C+O2 = 2CO2
3.Ca+C = CaC2
4.C+H2O = CO+H2
5.Fe2O3+C = CO+Fe
2C⁰+O₂⁰ = 2C⁺²O⁻²
C⁰ - 2e⁻ = C⁺² | 2 - восстан-ль
O₂⁰ + 4e = 2O⁻² | 1 - оксл-ль
2С⁺²O⁻² + O₂⁰ = 2C⁺⁴O₂⁻²
C⁰-4e⁻ = C⁺⁴ | 1 - восст-ль
O₂⁰+4e⁻ = 2O⁻² |1 - окисдлитель
Ca⁰ + C⁰ = Ca⁺²C₂⁻¹
Ca⁰ - 2e⁻ = Ca⁺² | 1
2C⁰ + 2e⁻ = 2C⁻¹ | 1
C⁰+H₂⁺O = C⁺²O + H₂
C⁰ - 2e⁻ = C⁺² | 1 восст-ль
2H⁺ + 2e⁻ = H₂⁰ | 1 окисл-ль
Fe₂⁺³O₃ + 3C⁺²O = 2Fe⁰ + 3C⁺⁴O2
Fe⁺³ + 3e⁻ = Fe⁰ | 2 окисл-ль
C⁺² - 2e⁻ = C⁺⁴ | 3 восст-ль