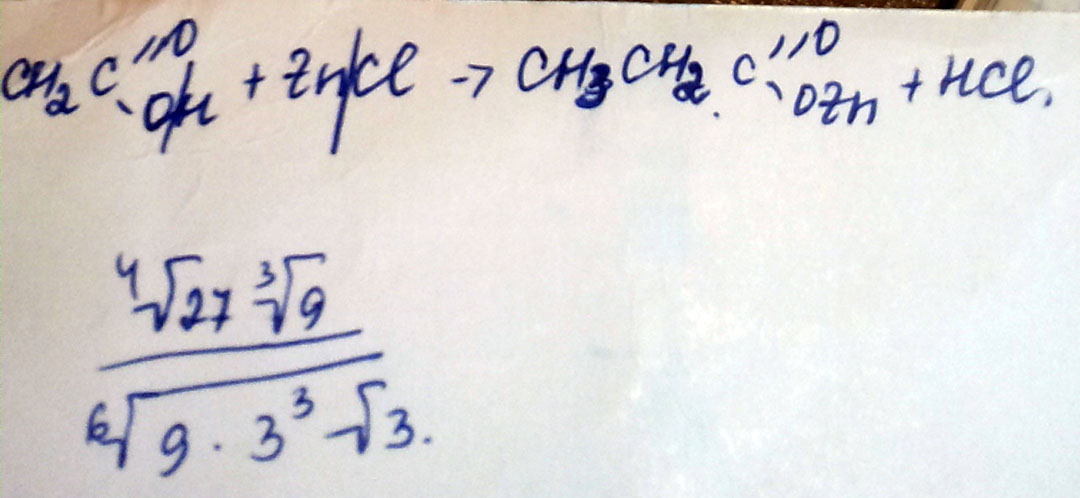Какую массу бромной воды (массовая доля брома 3%) обесцветят 2л пропина?
Решение задачи с полным оформлением.

Решение задачи с полным оформлением.

А CH₂=CH₂ + H₂ -> CH₃-CH₃ (Kt = Ni,t)
CH₂=CH₂ + HCl -> CH₃-CH₂Cl
CH₂=CH₂ + Br₂ -> Br-CH₂-CH₂-Br
CH₂=CH₂ + H₂O -> CH₃-CH₂-OH
CH₂=CH₂ + 3O₂ -> 2CO₂ + 2H₂O
б CH₃-CH = CH₂ + H₂ -> CH₃-CH₂-CH₃ (Kt = Ni,t)
CH₃-CH = CH₂ + HCl -> CH₃-CHCl-CH₃
CH₃-CH = CH₂ + H₂O -> CH₃-CHOH-CH₃
CH₃-CH = CH₂ + Br₂ -> CH₃-CHBr-CH₂Br
2CH₃-CH = CH₂ +9O₂ -> 6CO₂ + 6H₂O
в CH₃-C(CH₃)=CH₂ + HCl -> CH₃-CCl(CH₃)-CH₃
CH₃-C(CH₃)=CH₂ + H₂O -> CH₃-COH(CH₃)-CH₃
CH₃-C(CH₃)=CH₂ + Br₂ -> CH₃-CBr(CH₃)-CH₂Br
CH₃-C(CH₃)=CH₂ + H₂ -> CH₃-CH(CH₃)-CH₃
CH₃-C(CH₃)=CH₂ + 6O₂ -> 4H₂O +4 CO₂
г CH₃-CH₂-CH = CH₂ + H₂ -> CH₃-CH₂-CH₂-CH₃ (Kt = Ni,t)
CH₃-CH₂-CH = CH₂ + HCl -> CH₃-CH₂-CHCl-CH₃
CH₃-CH₂-CH = CH₂ + H₂O -> CH₃-CH₂-CHOH-CH₃
CH₃-CH₂-CH = CH₂ + Br₂ -> CH₃-CH₂-CHBr-CH₂Br
CH₃-CH₂-CH = CH₂ +6O₂ -> 4CO₂ + 4H₂O
д CH₃-CH = CH-CH₃ + H₂ -> CH₃-CH₂-CH₂-CH₃ (Kt = Ni,t)
CH₃-CH = CH-CH₃ + HCl -> CH₃-CH₂-CHCl-CH₃
CH₃-CH = CH-CH₃ + H₂O -> CH₃-CH₂-CHOH-CH₃
CH₃-CH = CH-CH₃ + Br₂ -> CH₃-CHBr-CHBr-CH₃
CH₃-CH = CH-CH₃ + 6O₂ -> 4CO₂ + 4H₂O
е CH₃-C(CH₃)=C(CH₃)-CH₃ + H₂ -> CH₃-CH(CH₃)-CH(CH₃)-CH₃
CH₃-C(CH₃)=C(CH₃)-CH₃ + Br₂ -> CH₃-CBr(CH₃)-CBr(CH₃)-CH₃
CH₃-C(CH₃)=C(CH₃)-CH₃ + H₂O -> CH₃-CH(CH₃)-C(OH)(CH₃)-CH₃
CH₃-C(CH₃)=C(CH₃)-CH₃ + HCl -> CH₃-CH(CH₃)-CCl(CH₃)-CH₃
CH₃-C(CH₃)=C(CH₃)-CH₃ + 9O₂ -> 6CO₂ +6 H₂O
1) Количество вещества пропена= V : Vm= 3л:22,4 л/моль=0,134 моль
2) Количество вещества пропена относится к количеству вещества кислорода, как 2:9 или 1:4,5====> количество вещества (О2)= 0,134 моль х4,5 = 0,6 моль.
3) Объем (О2)= количество вещества х Vm = 0,6 моль х 22,4 л/моль=13,5(л) -столько кислорода необходимо для реакции
4) Т. К. Объемная доля кислорода в воздухе = 21%(0,21), тогда V(воздуха = V(O2 13,5л ) / 0,21 =64(л).
1524г воздух 1м^3воздух
1. Этиленовый углеводород имеет формулу: б С6Н12
2. Пропан из пропилового спирта ОН-СН2-СН2-СН3 можно получить в результате реакции
б дегидратации
3. Качественной реакцией на непредельные углеводороды является
г обесцвечивание бромной воды
4. Реакция полимеризации характерна
в для пропена
Решение тут простое. Для начала нужно правильно расставить коэффициенты. Перед C3H6 2, O2 9. Потом нужно рассчитать молярную массу 9 молекул O2. M(9O2)= 9*32 = 288. У C3H6 нужно определить молярный объём. Vm(2C3H6)=2*22.4= 44.8 Составляешь пропорцию m(O2)* Vm(C3H6)/M(O2)
144* 44.8 / 288 = 22.4
Ответ выходит V(C3H6)= 22.4 л.
Пропионовая кислота и хлорид цинка между с собой обмениваются