Найдите в сетке филворда физические свойства, характерные для большинства металлов (н.у.):
Нету там не будет ли он в копии письма и не только русский язык и литература по оружию и на сайте и на какой стадии выполнения работ по договору поставки в наш офис
Ответ на картинке: блеск. Из неметаллов им обладает йод.

Особенность строения атомов металлов. Простые вещества- металлы, химическая связь, характерная для металлов. Физические свойства простых веществ. Причина общности физических свойств. Привести примеры с ярко выраженными физическими свойствами
На внешнем энергетическом уровне металлов 1-3 электрона. Образуют хим. связь с другими хим. элементами (нематаллов, металлическая связь. Степень окисления простых хим. элементов = 0.
1. Как не прибегая к химическим реакциям разделить алюминиевые и железные опилки?
2. В античные времена писали свинцовыми палочками. Почему для этого не использовали медь? Сравните физические свойства этих металлов.
3. Почему в истории человечества медь и свинец стали использоваться раньше чем железо?
4. Почему алюминий называют крылатым металлом?
1) Надо насыпать эти опилки вперемешку со струшкой на лист бумаги, потом сквозь бумагу снизу прикладываешь магнит и оттягиваешь их в сторону. Воуля, готово!
2) Свинец мягче меди.
3) Медь и свинец легче обрабатываются, железо трудней.
4) Потому что алюминий использовался для защиты самолетов, чтобы радиолокальные станции не улавливали сигнал от приблежающихся самолетов.
Вычислить массу аммиака NН3 объемом 33,6 м3
Сколько молекул содержится 71 г хлора?
Физические свойства металлов и неметаллов.
Составить схемы образования любых двух молекул.
во вложении
4. O2-ковалентная неполярная
Na-металлическая
KCl-ионная
H2S-ковалентная полярная
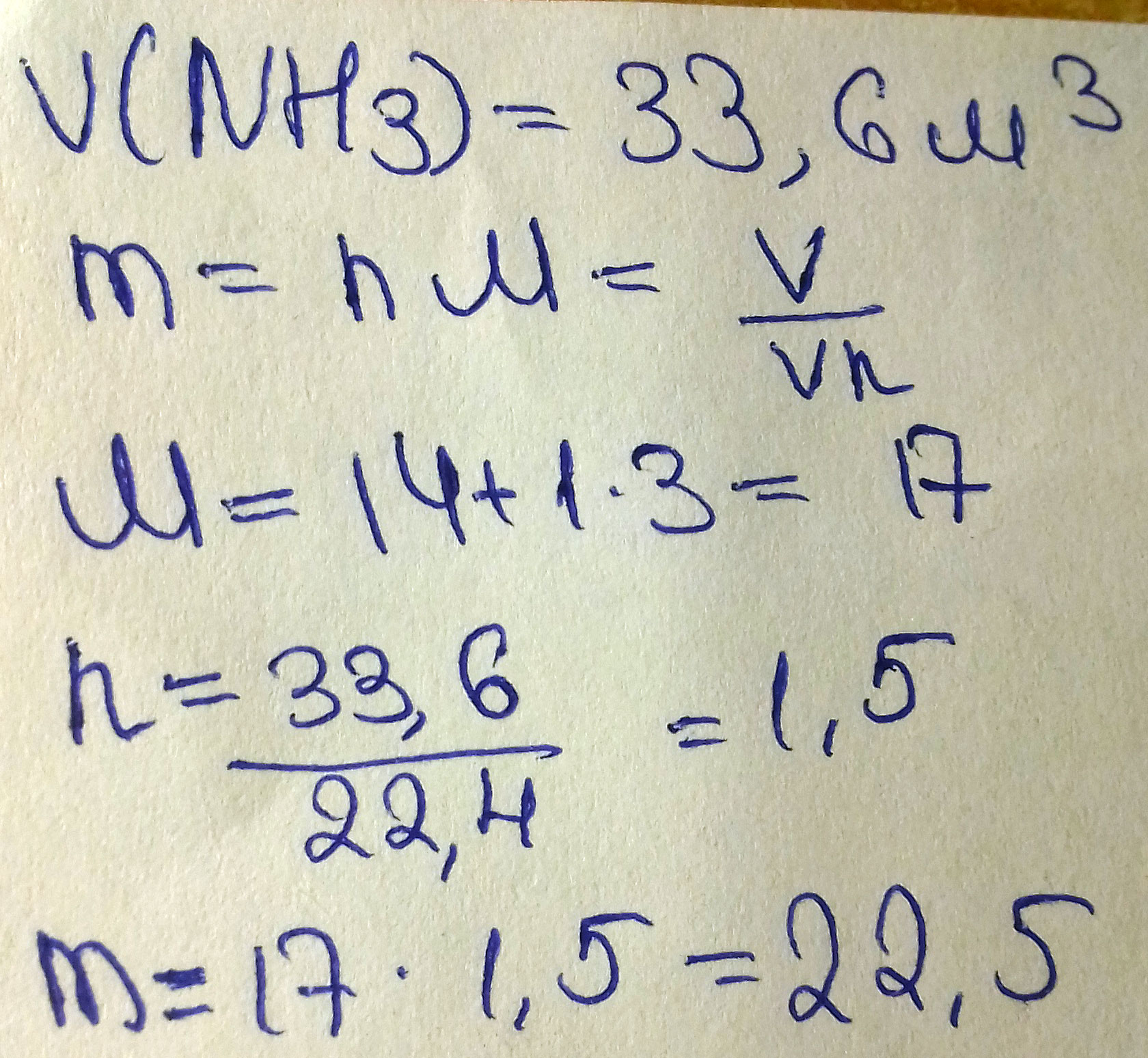
Общие физические свойства неметаллов.
Физические свойства неметаллов:
1. Элементы-неметаллы образуют простые вещества, которые при обычных условиях существуют в разных агрегатных состояниях: газы (благородные газы: He, Ne, Ar, Kr, Xe, Rn; H2, O2, N2, F2, Cl2.), жидкость (Br2), твердые вещества ( йод I2, углерод C, кремний Si, сера S, фосфор P и др. ).
2. Атомы неметаллов образуют менее плотно упакованную структуру чем металлы, в которой между атомами существуют ковалентные связи.
3. В кристаллической решетке неметаллов, как правило, нет свободных электронов. В связи с этим твердые вещества-неметаллы в отличие от металлов плохо проводят тепло и электричество, не обладают пластичностью.
Перечислите все физические свойства металлов с примерами использования этих свойств в быту/промышленности.
1. Кристалическая структура
2. Твердое агрегатное состояние при обвчных условиях.
3. Пластичность
4. Теплопроводность
5. Электропроводимость
6. Металлический блеск
7. Высокие температура плавления и кипения.
примеры хз вообще.
Основные физические свойства неметаллов
Теплопроводность: только углерод.
Электропроводность: только углерод и черный фосфор.
агрегатное состояние при комнатной температуре: твердое (например, фосфор и графит, жидкое (только бром или газообразное (например, кислород и хлор
Цвет: различный, например, бром красно-бурый, сера желтая, хлор желтовато-зеленый
Описать физические свойства металлов и указать металлы-рекордсмены
Общие физические свойства мекталлов:
1) Пластичность - способность изменять форму при ударе, вытягиваться в проволоку, прокатываться в тонкие листы. В ряду - Au, Ag, Cu, Sn, Pb, Zn, Fe уменьшается.
2) Блеск, обычно серый цвет и непрозрачность. Это связано со взаимодействием свободных электронов с пащими на металл квантами света.
3) Электропроводность. Объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. В ряду - Ag, Cu, Al, Fe уменьшается. При нагревании электропроводность уменьшается, т. к. С повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение "электронного газа".
4) Теплопроводность. Закономерность та же. Обусловлена высокой подвижностью свободных электронов и колебательным движением атомов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшая теплопроводность - у висмута и ртути.
5) Твердость. Самый твердый – хром (режет стекло; самые мягкие – щелочные металлы – калий, натрий, рубидий и цезий – режутся ножом.
6) Плотность. Она тем меньше, чем меньше атомная масса металла и чем больше радиус его атома (самый легкий - литий (r = 0,53 г/см3); самый тяжелый – осмий (r = 22,6 г/см3).
Металлы, имеющие r < 5 г/см3 считаются "легкими металлами".
7) Температуры плавления и кипения. Самый легкоплавкий металл – ртуть (т. Пл. = -39°C), самый тугоплавкий металл – вольфрам (t°пл. = 3390°C).
Металлы с t°пл. Выше 1000°C считаются тугоплавкими, ниже – низкоплавкими.
Все металлы являются восстановителями. Для металлов главных подгрупп восстановительная активность (способность отдавать электроны возрастает сверху вниз и справа налево. Например, Натрий и кальций вытесняют водород из воды уже при обычных условиях:
Ca + 2H2O Ca(OH)2 + H2; 2Na + 2H2O 2NaOH + H20
А магний при повышении температуры:
Mg + H2O –t MgO + H2
Восстановительная способность и химическая активность элементов побочных подгрупп увеличивается снизу вверх по группе (например, серебро на воздухе окисляется, а золото нет; медь вытесняет серебро из его соли:
Cu + 2AgNO3 → 2Ag ↓ + Cu(NO3)2
Cu0 -2 ē → Cu+2 1 О. О. В.
Ag+ + ē → Ag0 2 В. В. О.
Высшая положительная степень окисления для металлов главных подгрупп в их соединениях равна номеру группы (например, NaCl, MgCl2, AlCl3, SnCl4), а для металлов побочных подгрупп в их кислородосодержащих соединениях также часто совпадает с номером группы (например, ZnO, TiO2, V2O5, CrO3, KMnO4).
Свойства оксидов металлов слева направо по периоду и снизу вверх по группе изменяются от основных к амфотерным для металлов главных подгрупп (Na2O и MgO – основные оксиды, Al2O3 и BeO – амфотерные. Для металлов побочных подгрупп свойства оксидов, в которых металлы проявляют свою высшую степень окисления, изменяются от основных через амфотерные к кислотным ( CuO - основной, ZnO - амфотерный, CrO3 - кислотный.
Сила оснований, образуемых металлами главных подгрупп увеличивается справа налево по периоду и сверху вниз по группе ( Be(OH)2 и Al(OH)3– амфотерные гидроксиды, Mg(OH)2 - слабое основание, NaOHи – Ca(OH)2 сильные основания. Гидраты оксидов металлов побочных подгрупп с высшими степенями окисления металла вдоль периода слева направо меняют свои свойства от оснований через амфотерные гидроксиды к кислотам ( Cu(OH)2 - основание, Zn(OH)2 - амфотерный гидроксид, H2CrO4 - кислота.
В природе металлы встречаются в основном в виде соединений – оксидов или солей. Исключение составляют такие малоактивные металлы, как серебро, золото, платина, которые встречаются в самородном состоянии.
Все способы получения металлов основаны на процессах их восстановления из природных соединений.
Перечислите физические свойства металлов. Объясните связь физических свлйств металлов со строением их атомов
Все металла, кроме ртути, при норм. услов. Находятся в твёрдом состоянии. t плавления чистых металлов примерно от -39С до 3410С. Металлы делятся на лёгкие и тяжёлые ( взависимости от их плотности(точную плотность не знаю. Металлы пластичны. Имеют хорошую электро и теплопроводимость. Имеют характерный металлический блеск. В большинстве реакций вступают как восстановители.
Верно ли утверждение: у неметаллов одинаковые физические свойства
Нет! Потому что разные неметаллы имеют разные агрегатное состояние к примеру у брома агрегатное состояние жидкое а у фтор агрегатное состояние газовый
или у сери твердое агрегатное состояние
Верно только А
Атомы металлов никогда не проявляют окислительных свойств!