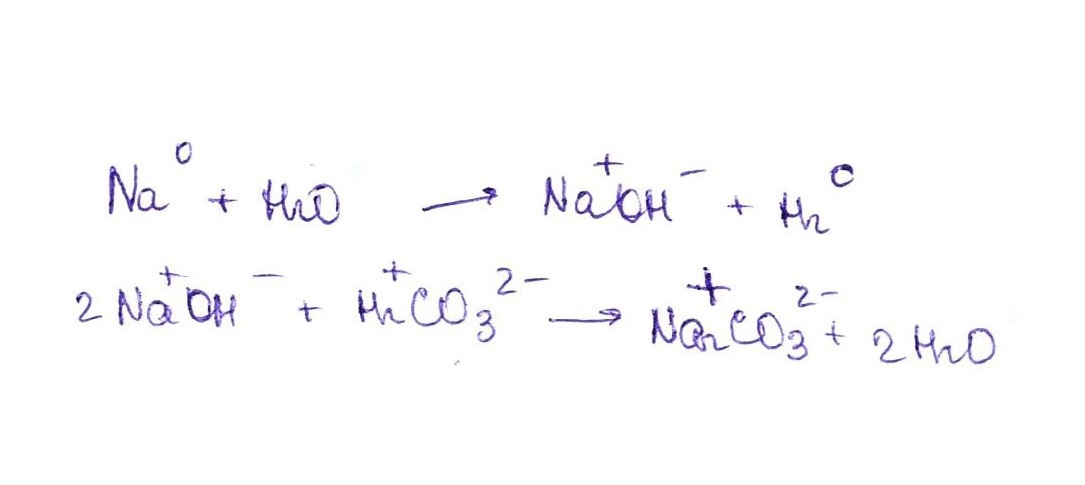Степень окисления - задачи и примеры
Определите степень окисления центрального Иона и Дайте названия веществам Запишите уравнения их диссоциации: K[Zn(IH)4],[Ag(NH3)2]OH, Na3(AlF6), Na4[Fe(CN)6],[Cr(H2O)6]Cl3.
1) K - это K+, значит, [Zn(IH)4] - однозарядный катион. Судя по тому, что I одновалентен и H одновалентен, группа IH должна быть нейтральной, тогда центральный ион - Zn+. Но цинк (по крайней мере, на моей памяти не проявляет степень окисления +1 и валентность 1. Для цинка характерна степень окисления +2. Исходя из этого, группа IH должна быть заряжена отрицательно - IH- Вообще это какое-то странное соединение, так что в ответе.
2) OH- однозарядный анион, значит, [Ag(NH3)2] - однозарядный катион
NH3 - нейтральная молекула, значит, центральный ион - Ag+
3) Na3 - это 3Na+, значит, [AlF6] - трехзарядный анион. F6 - это 6F- а нам нужно только три минуса. Значит, центральный ион - Al3+
4) Na4 - это 4Na+, значит, [Fe(CN)6] - четырехзарядный анион. CN6 - это 6CN- а нам нужно только четыре минуса. Значит, центральный ион - Fe2+
6) Cl3 - это 3Cl- значит, [Cr(H2O)6] - трехзарядный катион. H2O - это нейтральная молекула, значит, центральный ион Cr3+
Найти степень окисления по формулам:
Cl2O
CuBR2
FeS
BrO5
KN2
NClO
Na3PO4
CI2O у кислорода всегда (-2) т. к. Сумма степеней окисления должна быть равна 0, то у двух атомов XI должно быть +2, а у каждого из них (+2):2=+1
ответ: у кислорода -2 у хлора +1
Нужно охарактеризовать строение атома элемента №19(калий) по плану
1) положение в Периодической системе
2) металл или не металл
3) строение ядра
4) число энергетических уровней
5) число электронов на внешнем уровне
6) степень окисления
7) формула высшего оксида
1. Элемент 1 группы главной подгруппы
2. Металл
3. 2,8,8,1
4. 4 энергетических уровня, т. к. Находится в 4 периоде
5. 1 электрон на внешнем уровне
6. Степень окисления +1
7. Общая формула высшего оксида: R2O
Расставить степень окисления и уровнять Na➡NaOH➡NaCO3
Прикрепляю фотографию
Na2O+2KOH = 2NaOH+K2O 2NaOH+K2CO3 = Na2CO3+2KOH
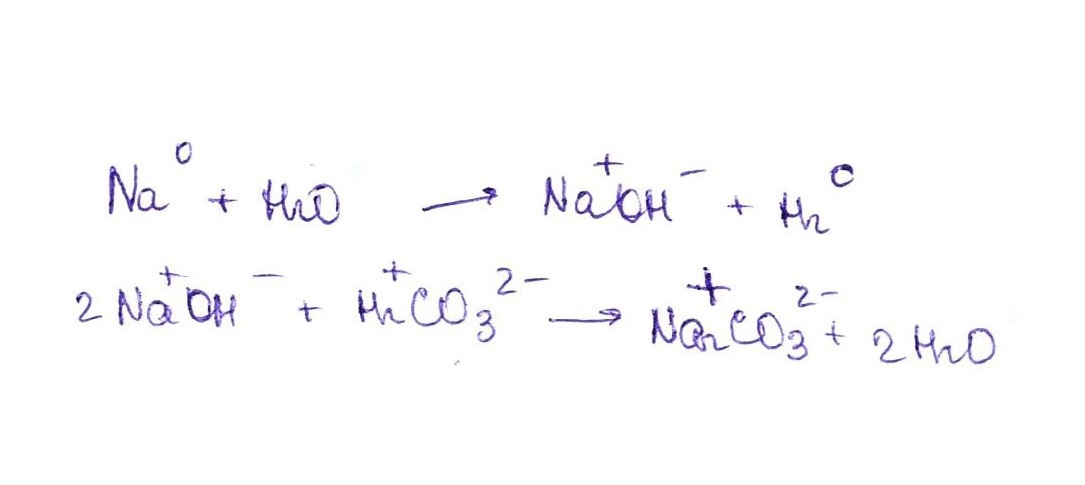
Назовите комплексные соединения, укажите
степень окисления комплексообразователя и координационное
число, ответьте на вопрос: в каком качестве в данных соединениях
представлены элементы VIIIБ подгруппы и выполните задания:
1) напишите уравнение полной диссоциации комплексного соеди-
нения; 2) напишите выражение константы нестойкости комплекс-
ного иона. [Ni(H2O)6]Cl2
Это хлорид гексаакваникеля (2). Степень окисления комплексообразователя +2, координационное число 6, комплексообразователь - никель.
1)
[Ni(H2O)6]Cl2 = [Ni(H2O)6](2+) + 2Cl(-)
2) Кн = [Ni2+]*[H2O]^6 / [[Ni(H2O)6]Cl2]
Определите степень окисления по формуле вещества:
1.2.1. AgCl; PbO2; CaS. 1.2.2. Fe3O4; Cr2O3; MnS.
1.2.3. CrO; H2Se; PCl3. 1.2.4. PCl5; Cl2O6; FeCl3.
1.2.5. Cl2O3; B2H6; Al2O3. 1.2.6. CuI; I2O5; HF.
1.2.7. AgCl; CaS; MnBr2. 1.2.8. CrO3; CrCl3; ZnS.
1.2.9. AuCl3; H2O2; PbI2. 1.2.10.SnCl2; SeO2; P2O3.
1.2.11. N2H4; PbCl2; CrCl2. 1.2.12. BeCl2; l2O7; OF2.
+1 -1 +4 -2 +2 -2 +2 -2 +3 -2 +3 -2 +2 -2
1.2.1. AgCl; PbO2; CaS. 1.2.2. Fe3O4= FeO*Fe2O3; Cr2O3;MnS.
+2 -2 +1 -2 +3 -1 +5 -1 +6 -2 +3 -1
1.2.3. CrO; H2Se; PCl3. 1.2.4. PCl5; Cl2O6; FeCl3.
+3 -2 +3 -2 +1 -1 +5 -2 +1 -1
1.2.5. Cl2O3; B2H6; -не прав. Ф-ла Al2O3. 1.2.6. CuI; I2O5; HF.
+1 -1 +2-2 +2 -1 +6 -2 +3 -1 +2 -2
1.2.7. AgCl; CaS; MnBr2. 1.2.8. CrO3; CrCl3; ZnS.
+3 -1 +1 -2 +2 -1 +2 -1 +4 -2 +3 -2
1.2.9. AuCl3; H2O2; PbI2. 1.2.10.SnCl2; SeO2; P2O3.
-2 +1 +2 -1 +2 -1 +2 -1 +7 -2 +2 -1
1.2.11. N2H4; PbCl2; CrCl2. 1.2.12. BeCl2; l2O7; OF2.
Степень окисления HCl, CO2, CO, Al2O3, KF
HCl- у водорода степень оки
$$ CO_{2} = C^{+4} O_2^{-2} $$
1) Первой части уравнения диссоциации карбоната калия соответствует запись:
1. =2K(+)+2CO3(2-)
2.=K(+)+HCO3(-)
3.=K(+)+CO3(2-)
4.=K(+)+2CO3(2-)
2) При диссоциации фосфорной кислоты по первой стадии образуются ионы:
A.HPO4(2-)
Б. PO4(3-)
B.OH(-)
Г. H(+)
Д. H2PO4(-)
Е. NO3(-)
Выберите ответ соответствующим буквам:
1. АВ
2. АБ
3. ГД
4. ДЕ
3) Необратимо протикает реакция ионного обмена между растворами:
1. Серной кислоты и хлорида бария
2. Сульфата натрия и карбоната калия
3. Нитрата калия и хлорида аммония
4. Гидроксид натрия и хлорид бария
4) Постоянная степень окисления +2 характерна для:
1.AL
2.NA
3.Ca
4.Fe
5) Процессу окисления соответствует схема изменения степени окисления:
1.P(+5)=> P(0)
2.P(+3)=> P(+5)
3.P(0)=> P(-3)
4.P(+3)=> P(0)
6) Установите соответствие между схемами превращения и уравнениями реакции отражающими эти превращения:
А. S(-2)=> S(+4) 1.NO2+SO2 = H20SO4+H2O+NO
Б. S(+4)=> S(+6) 2.2H2S+3O2 = 2SO2+2H2O
B.S(-2)=> S(0)
3.H2S+Pb(NO3)2 = PbS+2HNO3
4.2H2S+O2 = 2S+2H2O
7) Сокращенному ионному уравнению Ca(2+)+CO3(2-)=CaCO3 соответствует взаимодействие между:
1.Ca(OH)2 и CO2
2.Ca(NO3)2 и Na2CO3
3.Ca(OH)2 и K2CO3
4.CaO и CO2
5.Ca3(PO4)2 и K2CO3
8) Для обнаружения в растворе хлорид-ионов лаборант к порции испытуемого раствора прилил небольшое количество бесцветного раствора нитрата серебра. При этом образовался белый "творожистый" осадок. Запишите проведенную реакцию в молекулярном и ионных видах
9) При взаимодействии 9,8 г гидроксида меди(2) с соляной кислотой получили 10 г раствора хлорида меди(2). Вычислите массовую долю соли в полученном растворе
1) - Ответ должен быть: 2K(+)+CO3(2-) (у вас такого нет
2) - 3
3) - 1
4) - 3
5) - 2
6) - Если вы под буквой В имели ввиду уравнение №4, то ответ: В( уравнение №3 не подходит к букве В
7) - 2 (еще возможен вариант ответа №3, если считать, что Са(ОН2 растворимое основание
8) NaCl + AgNO3 = NaNO3 + AgCl↓
Cl(-)+Ag(+) = AgCl ( - в место натрия может быть любой металл главное, чтобы эта соль была растворима
Указать степень окисления, расставить коэффициенты, сделать эктронный баланс:
SnO2+CO = Sn+CO2
FeO+C = Fe+CO2
Sn(+4) O(-2) + C(+2) O(-2) = Sn(0) + C(+4) O(-2)
SnO2 + 2CO = Sn + 2CO2
Sn(+4) +4e = Sn(0) 1 ок-ль, в-ие
C(+2) -2e = C(+4) 2 в-ль, ок-ие
Fe(+2) O(-2) + C(0) = Fe(0) + C(+4) O(-2)
2FeO + C = 2Fe + CO2
Fe(+2) +2e = Fe(0) 2 ок-ль, в-ие
C(0) -4e = C(+4) 1 в-ль, ок-ие
Расставить степень окисления: K2Cr2O7+H2S+H2So4 = K2SO4+Cr2(SO4)3+S+H2O
K2Cr2O7+HCL = CL2+KCL+CrCL3+H2O
3H2S + 4H2SO4 + K2Cr2O7 = K2SO4 + 7H2O + 3S + Cr2(SO4)3
S(-2)-2e = S(0) 3 в-ль, ок-ие
2Cr(+6) +6e = 2Cr(+3) 1 ок-ль, в-ие
K₂Cr₂O₇ + 14HCl -> 2KCl + 2CrCl3 + 7H₂O + 3Cl2↑
Cr⁺⁶ +3e -> Cr⁺³ | 2 | восстановление, Cr⁺⁶ - окислитель
2Cl⁻ -2e -> Cl₂° | 3 | окисление, Cl⁻ - восстановитель