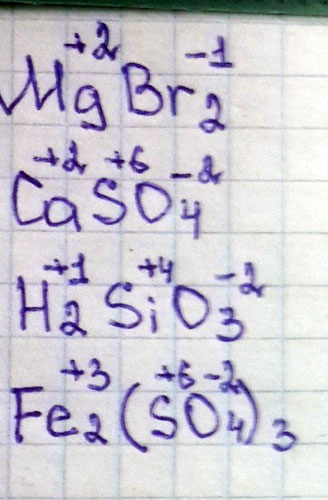Степень окисления - задачи и примеры
Окислительно -восстановительные реакции (ОВР - реакции, протекающие с изменением степени окисления одного или нескольких элементов.
Атом, отщий электрон, то есть повышающий свою степень окисления, называют восстановителем, а атом, принимающий электрон (его степень окисления понижается, – окислителем.
В какой реакции атом окислителя принимает в два раза меньше электронов, чем отдает атом восстановителя?
P(красн+KSlO₃⇒
комн. Кач.
H₂S+SO₂ ⇒ H₂O
Cu+HNO₃ (конц. ) ⇒
SuSO₄+NaOH⇒
Cu + 4HNO3 => Cu(NO3)2 + 2NO2 + 2H2O
Cu⁰ - 2e⁻ = Cu⁺² | 2 | | 1 | восстановитель, окисление
| | 2 | |
N⁺⁵ + 1e⁻ = N⁺⁴ | 1 | | 2 | окислитель, восстановление
окислитель принимает 1 электрон, восстановитель отдает 2
подходит только это.
Kmno4+k2so3+h2o = MnSO4+S+K2SO4+H2O ОВР расставить коэффиценты и степень окисления
При сложении таких веществ, должно выйти такое уравнение
2K⁺¹Mn⁺⁷O⁻²₄+3K⁺¹₂S⁺⁴O⁻²₃+H⁺¹₂O⁻² = 3K⁺¹₂S⁺⁶O⁻²₄+2Mn⁺²O⁻²₂+2K⁺¹O⁻²H⁺¹ Укажите атомные массы и степень окисления эелементов которые окисляются: Fe2O3+CO->Fe+CO2
Fe2O3 + 3CO = 2Fe + 3CO2
Баланс
$$ \left. \begin{array}{r}\\{C^{+2}-2e^{-} o C^{+4}}\\{Fe^{+3}+3e^{-} o Fe^{0}} \end{array} \right|6 \left| \begin{array}{l} \\{3-reducing;agent}\\{2-oxidizing;agent} \end{array} \right. $$
Окисляется углерод. Его атомная масса = 12, а изменение степеней окисления дано в балансе.
Составить определение Zn (цинка) по таблице Менделеева. Заряд ядра, число электронов, число энергетических уровней, электронная формула, высшая степень окисления, формула высшего оксида и соответствующего ему гидроксида.
1. Заряд ядра = 30.
2. Число электронов =30.
3. Число энергетических уровней =4, по этому он находится в 4 периоде.
4. Высшая ст. Окисления = 2+
5. Высший оксид имеет формулу ZnO.
6. Высший гидроксид имеет формулу Zn (OH)2
Вставьте пропущенные слова: 2) Ряд химических элементов, расположенных в порядке возрастания их ___
начинающийся с водорода или щелочного металла и заканчивающийся благородным газом, называют___
5) Вертик. Ряд элементов имеющих одинаковую высшую степень окисления, называется___
6) Из элементов малых и больших периодов состоят___подгруппы. Из этих элементов только больших периодов состоят___подгруппы. Например, в состав второй побочной подгруппы входят элементы___
2) Ряд химических элементов, расположенных в порядке возрастания их _относительных атомных масс__
начинающийся с водорода или щелочного металла и заканчивающийся благородным газом, называют__периодом_
5) Вертик. Ряд элементов имеющих одинаковую высшую степень окисления, называется__группой_
6) Из элементов малых и больших периодов состоят__главные _подгруппы. Из этих элементов только больших периодов состоят_побочные __подгруппы. Например, в состав второй побочной подгруппы входят элементы_Zn.Cd.Hg__
Характеристика Серы и Фосфора
* Распределение электронов в атоме - электронная формула и электронная диаграмма (электронные ячейки
* Высшая положительная степень окисления
* Отрицательная степень окисления
* Высший оксид, его химический характер, у. Х. Р. Подтвержщие его св-ва.
* Высший гидроксид, его характер, у. Х. Р. Подтвержщие его св-ва
* Высшее летучее водородное соединение
* Сравнение свойств элемента с элементами в периоде
* Сравнение свойств элемента с элементами в подгруппе
1. Фосфор находится в главной подгруппе V группы, в 3-м периоде.
2. Химический элемент номер 15 - Фосфор. Его символ Р.
3. Заряд ядра атома фосфора равен +15. Относительная атомная масса фосфора равна 31. Ядро атома содержит 15 протонов и 16 нейтронов (31 - 15 = 16. Атом фосфора имеет три энергетических уровня, на которых находятся 15 электронов.
4. Электронная формула атома фосфора: 15P 1s2 2s2 2p6 3s2 3p3.
Электронно-графическая формула внешнего уровня атома фосфора: на третьем энергетическом уровне на 3s-подуровня находятся два электрона (в одной клетке записываются две стрелки, имеющие противоположное направление, на три р-подуровне находятся три электрона (в каждой из трех клеток записываются по одной стрелке, имеющие одинаковое направление.
Валентными электронами являются электроны внешнего уровня, т.е. 3s2 3p3 электроны.
5. Фосфор - неметалл. Поскольку в последнее подуровнем в атоме фосфора, который заполняется электронами, является p-подуровень, Фосфор относится к семейству p-элементов.
6. Высший оксид фосфора P2O5, проявляет свойства кислотного оксида. Гидроксид, соответствующий высшему оксиду, H3PO4, проявляет свойства кислоты. Подтвердим указанные свойства уравнениями видповиних химических реакций:
P2O5 + 3 Na2O = 2Na3PO4
H3PO4 + 3NaOH = Na3PO4 + 3H2O
7. Соседом фосфора по подгруппе являются азот. Соседями фосфора за периодом является кремний и Сера. Неметаллические свойства атомов химических элементов главных подгрупп с ростом порядкового номера растут в периодах и снижаются в группах. Поэтому неметаллические свойства фосфора более выражены, чем у кремния и менее выражены, чем у азота и серы.
8. Максимальный положительный степень окисления для химических элементов главных подгрупп равен номеру группы. Фосфор находится в главной подгруппе пятой группы, поэтому максимальная степень окисления фосфора +5. Минимальная степень окисления для неметаллов в большинстве случаев равен разнице между номером группы и числом восемь. Так, минимальная степень окисления фосфора -3.
Какую степень окисления NH3
NH3 - аммиак
Азот (N) имеет степень окисления минус три (-3)
Водород (Н имеет степень окисления плюс один (+1)
Определение начинаем с водорода на нем плюс, а водородов у нас три, значит, три плюса. Т. К. NH3 - молекула, то заряд скомпенсирован, должно быть три минуса. Т. К. Азот один то на нем получается и есть три минуса.
Задача 4. Окислители
Определение
Окислительно -восстановительные реакции (ОВР - реакции, протекающие с изменением степени окисления одного или нескольких элементов.
При окислительно-восстановительных реакциях происходит переход электронов от одних атомов к другим.
Атом, отщий электрон, то есть повышающий свою степень окисления, называют восстановителем, а атом, принимающий электрон (его степень окисления понижается – окислителем.
Подумайте какие вещества могут быть окислителями, а какие - восстановителями.
Только окислительные свойства могут проявлять:
Соляная кислота
Бром
Вода
Пероксид водорода
Сернистый газ
Азот
Серная кислота
Кислород
Кремнезем
Каждое соединение (точнее элементы в соединениях могут быть или только восстановителями, или окислителями, или и тем и другим. Поэтому дадим характеристику элементам
Соляная кислота (HCl) - водород (+1) может здесь выступать только окислителем, а хлор (-1) только восстановителем.
Бром (Br2) - здесь бром (0) может быть как окислителем так и восстановителем.
Вода (H2O) - здесь водород (+1) только окислитель, а кислород (-2) только восстановитель.
Пероксид водорода (Н2О2) - водород (+1) здесь только восстановитель, а кислород (-1) может быть как окислителем так и восстановителем.
Сернистый газ (SO2) - сера (+4) здесь может быть и окислителем и восстановителем, а кислород (-2) только восстановитель.
Азот (N2) - азот (0) здесь может быть как окислитель так и восстановитель.
Серная кислота (H2SO4) - здесь по большей части в окислительно-восстановительных реакциях участвуют водород и сера, поэтому водород (+1) здесь только окислитель и сера (+6) только окислитель.
Кислород (О2) - здесь кислород (0) может быть как окислителем так и восстановителем.
Кремнезем (SiO2) - здесь кремний (+4) только окислитель, а кислород (-2) только восстановитель.
Степень окисления Mg Br2, CaSO4, H2SiO3, Fe2(SO4)
MgBr2
Mg(+2) Br(-1)
Ca(+2) (SO4)(-2)
H2(+1) Si(+5) (O3)(-2)
Fe2(+3) (SO4)(-2)
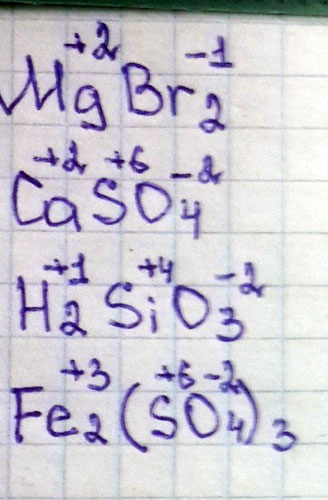
Валентность и степень окисления:
C2H2
C3H6
C5H10
По-моему в органических веществ особо степени окисления не ставят. Валентность во всех соединениях у углерода - IV, у водорода - I
во всех соединениях ст. Окисления водорода +1, а углерода
C2H2 -1
C3H6 -2
C5H10 -2