Оксид химического элемента 1 группы имеет молярную массу 30, назвать элемент и составить формулу его гидраксида
На фото, E - невідомий елемент.
Этот оксид Li2O(основный оксид
а гидроксид металла:Li(OH)
Li)2)1
заряд ядра:+1
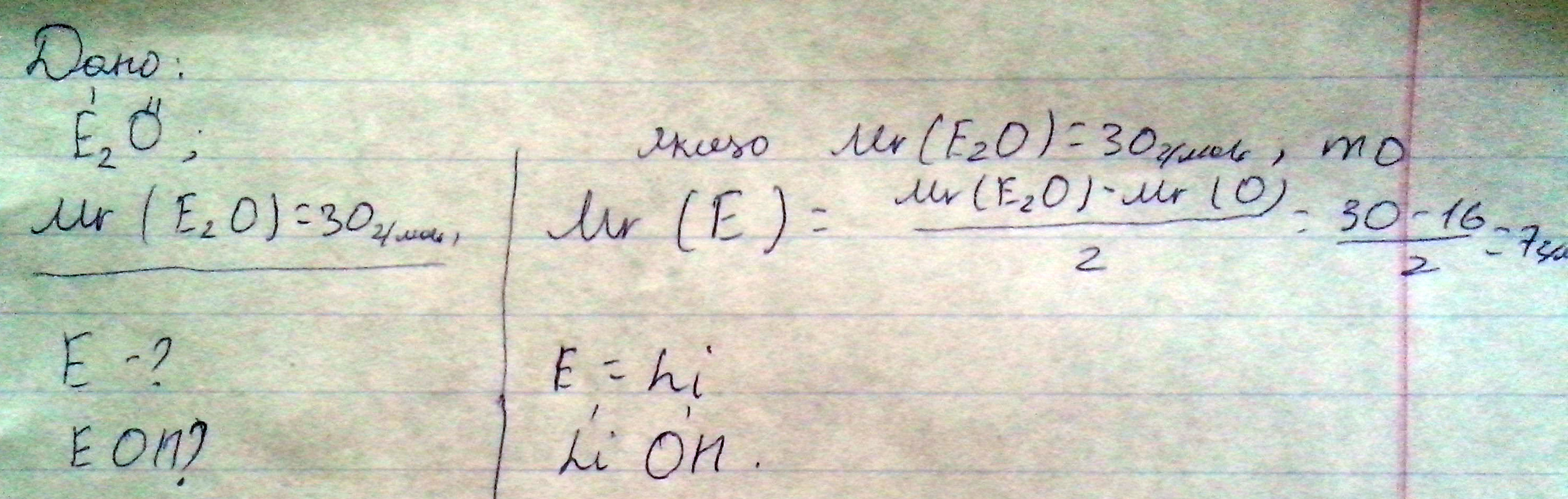
На фото, E - невідомий елемент.
Этот оксид Li2O(основный оксид
а гидроксид металла:Li(OH)
Li)2)1
заряд ядра:+1
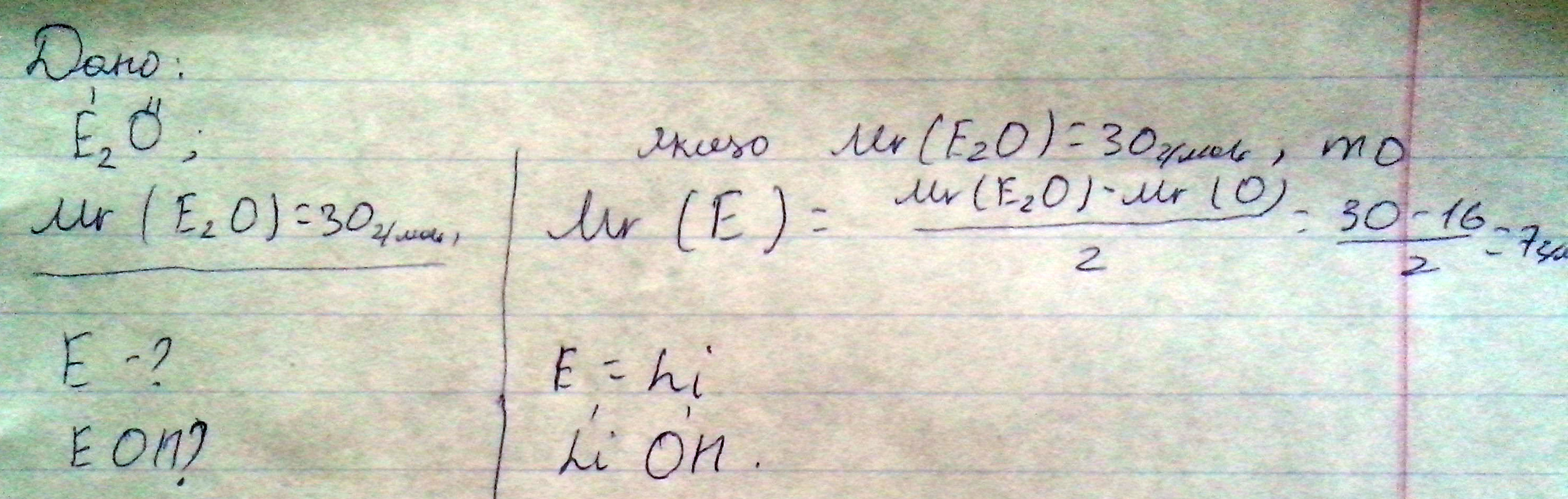
Если элемент имеет степень окисления +4, то формула оксида будет иметь вид: XO2
Найдем его молекулярную массу:
Mr(XO2) = 2*32 = 64
Зная, что массовая доля для кислорода составляет 50%, найдем атомную массу элемента: 64*0.5 = 32
м в таблицу Менделеева, находим элемент с атомным весом 32 - это сера, формула оксида SO2, формула водородного соединения H2S
1. Fe2O3-Fe(+3); O(-2)
CO-C(+2);O(-2)
FeCl3-Fe(+3);Cl(-1)
Cu2O-Cu(+1);O(-2)
H2S-H(+1);S(-2)
BaBr2-Ba(+2);Br(-1)
SO2-S(+4);O(-2)
AlF3-Al(+3);F(-1)
2.Li2O
H2S
N2O
Mr(Me2O) = 2х+16 = 30
Ar(Me) = (30-16)/2 = 7
Следовательно, это литий - Li
LiOH - формула гидроксида
Mr(оксида = количество молекул металла * атомную массу металла + атомная масса кислорода.
Следовательно, 30 = х+16
х=14, а атомная масса водорода слишком мала, а атомная масса натрия слишком велика, то получается что нам подходит литий. Если составить формулу то получится Li2O.
А формула гидроксида будет LiOH
Ответ: Li; LiOH
1) Атому неметалла с наибольшим радиусом соответствует электронная конфигурация
Б и Г откидываем так как там только ДВА энергетических уровня, (электронные оболочки (что-то вроде шубок, которые на себя одевает атомное ядро а в вариантах А и В есть ТРИ уровня, следовательно радиус уже ЗНАЧИТЕЛЬНО больше.
Рассматриваем варианты А и В. В А в электронной оболочке на два электрона меньше чем, в B, но нужно учитывать, что и заряд ядра на два больше, а значит и отрицательно заряженные электронны притягиваться будут сильнее (минус притягивается к плюсу и в итоге оболочка сузится. Значит два электрона, добавленные на одном уровне уменьшили радиус атома, следовательно НАИБОЛЬШИМ будет атом с электронной оболочкой A
2) a) В первом рассматриваемом случае диссоциация возрастет, так как молекулы воды будут вследствие своей более высокой скорости (из-за нагрева активнее "расстаскивать" молекулы уксуса.
бПри разбавлении раствора диссоциация тоже увеличится, так как возрастет количество молекул "расстаскивающих" уксус.
в Сильная кислота заполонит расствор катионами водорода и у уксусной кислоты не будет нужды диссоциировать (диссоциировать, значит распадаться на ионы (H+ и СH3COO-) Следовательно правильный ответ В
3) Среда становится кислой, если в растворе много катионов водорода. Среда щелочная, если много гидроксогрупп. Если вещество образовано сильной кислотой и слабым основанием, значит она хорошо распадается на протоны (катионы водорода и плохо на гидроксогруппы. Следовательно, в растворе будет мноооооого протонов и мало гидроксогрупп и среда станет кислой. Следовательно кислую среду имеют растворы солей, образованных сильной кислотой и слабым основанием. Сила кислот и оснований определяется степенью диссоциацией (меры распадания вещества на ионы - кто лучше распадается, тот и сильнее
Фосфат натрия образован кислотой средней силы (H3PO4 - ортофосфорной и очень сильным основанием гидроксидом натрия NaOH. Среда будет щелочная.
Гидрофосфат натрия - соль с формулой Na2HPO4. Как мы видем внутри вещества уже содержится один протон (катион водорода, что уже само собой повышает кислотность среды, но гидроксид натрия всё равно более сильное основание, поэтому среда получается в целом почти нейтральная.
Дигидрофосфат натрия -соль с формулой NaH2PO4. Два протона водорода! А это значит, что их количество в воде по сравнению с предыдущей солью будет тоже в ДВА раза больше! Избыток катионов водорода в растворе как раз делает кислотную среду, несмотря на то, что соль образована так же с участием очень сильной щёлочи гидроксида натрия. Итого: ответ 3
Гексан диол
При взаимодействии с азотистой кислотой образуется гексан-диол-1,6 [c.203]
Сточные воды стадии изомеризации содержат до 400 г/л органически соединений и до 1,5 г/л солей Сточные воды стадии конденсации содержат ацетон, хлорбензол, гексан-диол, едкое кали и ацетат калия [c.331]
Дигидро-2Н- пиран-2-карбокси- альдегид 3,4-Дигидро-2Н-пиран-2-карбокси-метанол, 1,6-гексан-диол (I) Окисный медно-хромовый жидкая фаза, = = 50—120 бар, ниже 250 С образуется только I [118] [c.487]