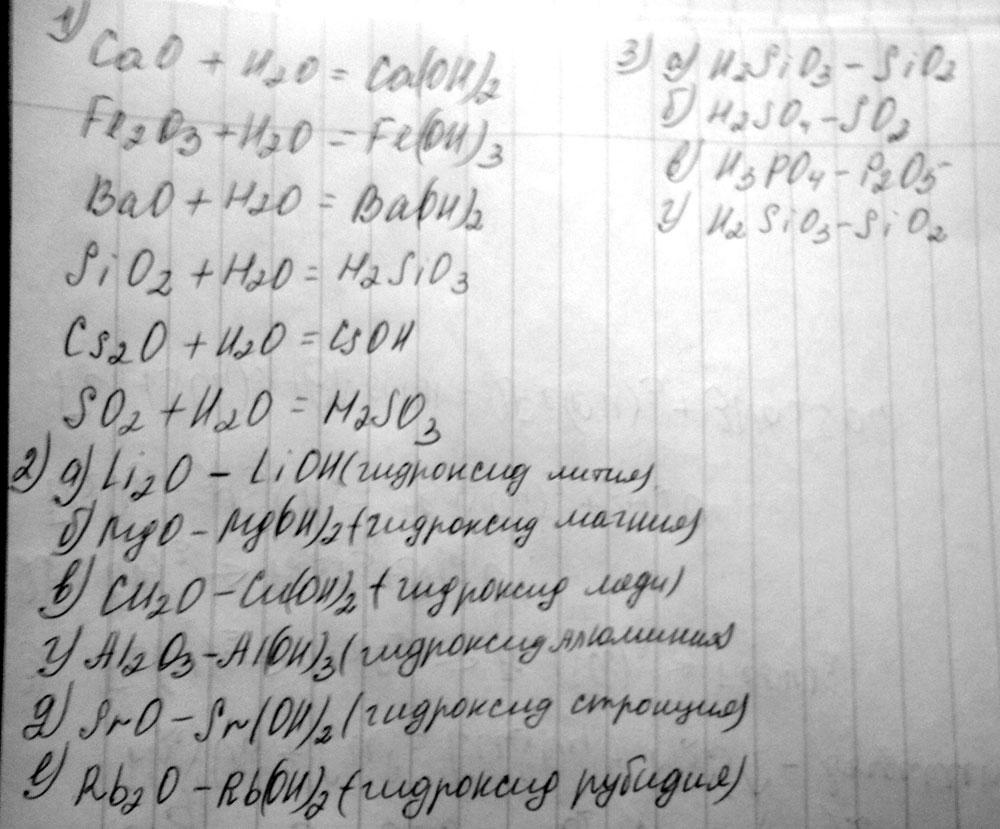Напишите формулы и объясните - задачи и примеры
1. Какие из перечисленных оксидов: СаО, Fe2O3, BaO, SiO2, Cs2O, SO2 – будут реагировать с водой. Написать уравнения возможных реакций.
2. Рядом с формулой указанного оксида напишите формулу соответствующего ему основания и назовите его:
а Li2O – в Cu2O– д SrO–
б MgO– г Al2O3– е Rb2O–
3. Напишите формулы оксидов, которые соответствуют следующим кислотам:
а H2SiO3б H2SO4в H3PO4г H2SiO3
1) CaO + H2O -> Ca(OH)2
BaO + H2O -> Ba(OH)2
Cs2O + H2O -> 2CsOH
SO2 + H2O -> H2SO3
2) Li2O. LiOH. Гидроксид лития
МgO. Mg(OH)2. Гидроксид магния
Сu2O - CuOH. Гидроксид меди(1)
Al2O3. Al(OH)3. Гидроксид алюминия
SrO. Sr(OH)2. Гидроксид стронция
Rb2O. RbOH. Гидроксид рубидия
3) H2SiO3. SiO2
H2SO4. SO3
H3PO4. P2O5
H2SiO3. SiO2
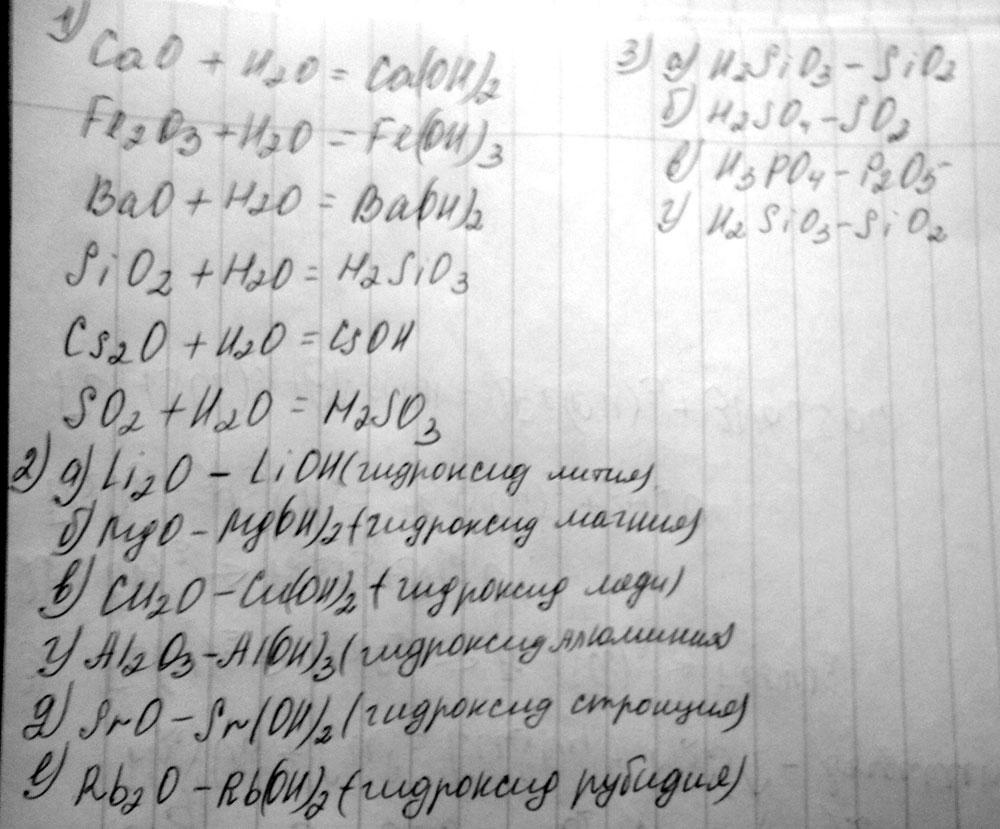
Напишите формулы и дайте названия известным вам кислот
8 класс
HF - фтороводородная (плавикивая
HCl - хлороводородная (соляная
HBr - бромоводородная
HI - иодоводородная
HNO3 - азотная
HNO2 - азотистая
1) H2SO4 - серная кислота
2) HCl - соляная кислота
3) H2CO3 - угольная кислота
4) H2SO3 - сернистая кислота
5) HF - плавиковая (фтороводородная кислота
6) HNO3 - азотная кислота
7) HNO2 - азотистая кислота
8) H3PO4 - ортофосфорная кислота
9) H2SiO3 - метакремниевая кислота
1) какими свойствами обладает элемент с порядковым номером 18? Почему?
2) Какой из элементов C или N обладает более сильными неметаллическими свойствами? Почему?
3) как записывается формулы оксида этого элемента?
4) Какой из элементов углерод или кремний обладает более сильными неметаллическими свойствами? Почему?
5) Какими свойствами обладает элемент с порядковым номером 10? Почему?
6) Какие свойства проявляет элемент с порядковым номером 25? Почему?
7) напишите формулы оксида
1.) По порядковому номеру это Аргон
В атмосфере содержится около 0,9% аргона. Аргон, который, как и азот, представляет собой нейтральный бесцветный газ, существует в природе только в составе атмосферного воздуха. Он не пригоден для поддержания жизни, однако незаменим в некоторых технологических процессах благодаря высокому уровню химической инертности и относительной простоте извлечения.
2.) Азот (N) Давайте посмотрим в таблицу Менделеева. По периодическому закону, неметалы а именно ихние свойства возрастают слева направо и снизу вверх. То азот проявляет наиболее выраженные неметалические свойства
3.) NO-оксид азота (II)
4) углерод (СПо периодическому закону, неметалические свойства возрастают слева направо и снизу вверх. Т. К. Оба неметалла находятся в одной группе и Кремний ниже Углерода, то углерод проявляет наиболее выраженные неметалические свойства
5.) Неон – легкий газ: он легче воздуха в 1,44 раза, аргона — почти в 2 раза, но тяжелее гелия в 5 раз. По комплексу свойств он ближе к гелию, чем к аргону, и вместе с гелием составляет подгруппу легких инертных газов. Неон сжижается при температуре –245,98°C. Точка плавления неона отстоит от точки кипения всего на 2,6°C– рекордно малый диапазон, свидетельствующий о слабости сил межмолекулярного взаимодействия в неоне. Благодаря этому твердый неон получается без особого труда: достаточно недолго откачивать пары над жидким неоном, чтобы он отвердел. Это шестой по распространённости элемент во Вселенной — после водорода, гелия, кислорода, азота и углерода. Его существование предсказали дважды. Он был назван «в честь» греческого слова neos, что значит «новый». И еще — без этого газа наша жизнь вряд ли была бы такой яркой, как сегодня.
6.) Плотность Марганца 7,2-7,4 г/см3; tпл 1245 °С; tкип 2150 °С. Марганец имеет 4 полиморфные модификации: α-Мn (кубическая объемноцентрированная решетка с 58 атомами в элементарной ячейке, β-Мn (кубическая объемноцентрированная с 20 атомами в ячейке, γ-Мn (тетрагональная с 4 атомами в ячейке и δ-Mn (кубическая объемноцентрированная. Температура превращений: α = β 705 °С; β = γ 1090 °С и γ = δ 1133 °С; α-модификация хрупка; γ (и отчасти β) пластична, что имеет важное значение при создании сплавов.
6.) MnO,
MnO2
Mn2O7
Алгоритм решения задач на нахождение массы и количества вещества по уравнениям реакций, 8 класс (Напишите формулы)
Возьмем для примера задачку.
===========================================
В реакцию с соляной кислотой вступило 13 г цинка. Определите массы израсходованной кислоты и полученной соли, а также объем выделившегося газа. ===========================================
Сначала немного теории:
1. Запоминаем формулы:
n = m:M | n - кол-во вещества(моль; m - масса; M - молярная масса;
n = V:22.4 | V - объем; действительно только для газов!
2. Что означают коэффиценты в уравнении для таких заданий? Это соотношение, допустим:
2H2+O2 = 2H2O
Водород относится к кислороду, как 2:1, предположим, что у нас 4 моль водорода, значит кислорода 2 моль.
тут понятно.
==============================================
Теперь сама задача
==============================================
1. Пишем уравнение реакции:
Zn+2HCl= ZnCl2+H2
2. Находим молярную массу данных веществ по формуле:
n(Zn)=m:M = 13:65 = 0.2моль
3. По уравнению находим кол-во МОЛЬ остальных веществ:
n(HCl)=0.4 МОЛЬ
n(ZnCl2)=0.2 МОЛЬ
n(H2)=0.2 МОЛЬ
4. Находим массы:
m(HCl)=0.4*36.5 = 14.6 г.
m(ZnCl2)=0.2*136 = 27.2 г.
V(H2)=n*22.4 = 0.2*22.4 = 4.48 л.
====================================
Напишите формулы элементов третьего периода (номер 11 12 13) Укажите Как изменяется характер их свойств с увеличением
зарядов ядер их
атомов. Охарактеризуйте их
Na 1s2 2s2 2p6 3s1
Mg 1s2 2s2 2p6 3s2
Al 1s2 2s2 2p6 3s2 3p1
с увеличением заряда ядер их атомов уменьшается радиус атомов, ослабевают металлические и восстановительные свойства
Заряд ядра элемента Х равен +6.4 умноженное на 10 в 19 степени Кл. Определите элемент, напишите формулы соединений элемента с водородом, кислородом (оксида, фтором, азотом. В ответе укажите суммарное число всех атомов в этих соединениях.
Заряд протона равен заряду электрона. Заряд = +/- 1,6*10^-19 Кл. Z = ē = 6,4*10^-19 Кл / 1,6*10^-19 Кл = 4, что соответствует бериллию. (С водородом BeH2 - 3 атома. (С кислородом BeO - 2 атома. (С фактором BeF2 - 3 атома. (С азотом Be3N2 - 5 атомов.