1. Валентность углевода в органических веществах
2. Главная причина многообразия органических веществ-явления
3. Ряд, сходных по составу, строению и свойствам вещества
4. Первый член гомологического ряда алканов
5. Какой реакцией можно перейти от алканов к алкину?
6. В какой реакции применяют правильно Марковникова?
7. Качественная реакция на кратную связь
8. Мономер синтетического каучука
9. Температура ацетилено-кислородного пламени
10. Одновалентный радикал бензола
1 - 4
2 - наличие изомерии, образуют цепи и кольца
3 - гомологи (алканы, алкены, алкины
4 - метан
5 - дегидрирования
6 - присоединения несимметричной молекулы
7 - обесцвечивание бромной воды, окисление KMnO4
8 - Алкадиен
9 - 3200
10- С6H5
Для 3-метилбутин-1 составьте формулы:
а) изомерия положения тройной связи б) изомера из другого гомологического ряда углеводородов вгомолога с более длинной углеродной цепью
А - это Пентин-1
Б - это Пентадиен-1,3
В - это Гексен-2
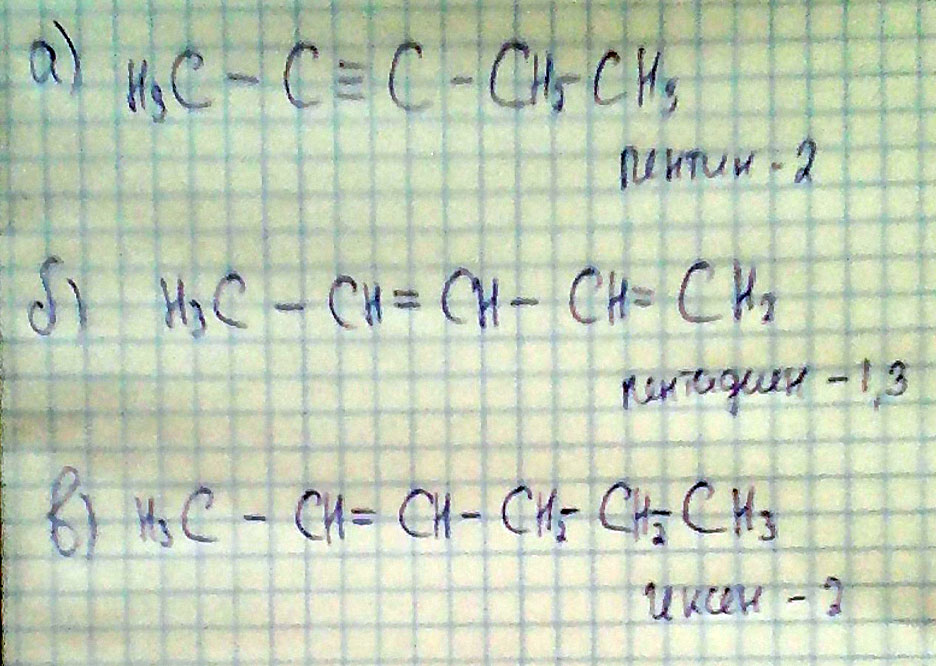
C5H8 Составьте формулы 3 гомологических рядов и их сокращённые формулы
CH≡C-CH2-CH2-CH3 пентин-1 (C5H8)
CH≡C-CH2-CH3 бутин-1 (C4H6)
CH≡C-CH3 пропин-1 (C3H4)
CH≡C-CH(CH3)-CH3 3-метилбутин-1 (C5H8)
CH≡C-CH(CH3)-CH2-CH3 3-метилпентин-1 (C6H10)
CH≡C-CH(CH3)-CH2-CH2-CH3 3-метилгексин-1 (C7H12)
CH3-C≡C-CH2-CH3 пентин-2 (C5H8)
CH3-C≡C-CH2-CH2-CH3 гексин-2 (C6H10)
CH3-C≡C-CH2-CH2-CH2-CH3 гептин-2 (C7H12)
Гомологический ряд и изомерия моносахаридов? ((
Строение моносахаридов (моноз
Моносахариды (монозы являются гетерофункциональными соединениями. В их молекулах одновременно содержатся и карбонильная (альдегидная или кетонная, и несколько гидроксильных групп, т.е. Моносахариды представляют собой полигидроксикарбонильные соединения - полигидроксиальдегиды иполигидроксикетоны.
В зависимости от этого моносахариды подразделяются на альдозы (в моносахариде содержится альдегидная группа и кетозы (содержится кетогруппа. Например, глюкоза – это альдоза, а фруктоза – это кетоза.
глюкоза фруктоза
В зависимости от числа атомов углерода в молекуле моносахарид называется тетрозой, пентозой, гексозой и т. д. Если объединить последние два типа классификации, то глюкоза – это альдогексоза, а фруктоза – кетогексоза. Большинство встречающихся в природе моносахаридов – это пентозы и гексозы.
Номенклатура моносахаридовВ основу номенклатуры альдоз положены тривиальные названия моносахаридов составаCn(H2O) nCn(H2O) n с линейной цепью углеродных атомов: рибоза, глюкоза, фруктоза.
Название кетоз образуются введением суффикса "-ул" - в название соответствующей альдозы: рибоза → рибулоза; некоторые кетосахара имеют тривиальные названия, например, фруктоза (кетогексоза.
стереоИзомерия моносахаридовДля моносахаридов характерны несколько видов изомерии.
1. Межклассовая изомерия. Альдозы и кетозы являются межклассовыми изомерами
2. Оптическая изомерия. Наличие нескольких асимметрических атомов углерода обусловливает существование большого числа оптических изомеров у моносахаридов.
ОПРЕДЕЛЕНИЕАсимметрический атом углерода (хиральный центр - это атом углерода, связанный с четырьмя различными атомами или группами атомов
Моносахариды изображаются в виде проекционных формул Фишера, т.е. В виде проекции тетраэдрической модели атомов углерода на плоскость рисунка. Углеродная цепь в них записывается вертикально. У альдоз наверху помещают альдегидную группу, у кетоз – соседнюю с карбонильной первичноспиртовую группу. Нумерацию начинают с верхнего атома углерода. Атом водорода и гидроксильную группу при асимметрическом атоме углерода располагают на горизонтальной прямой. Асимметрический атом углерода находится в образующемся перекрестье двух прямых и не обозначается символом.
С ростом числа асимметрических центров число пространственных изомеров возрастает, причем:
Запомнить! Каждый новый асимметрический центр вдвое увеличивает число возможных изомеров; число изомеров определяется формулой N = 2nN=2n, где n - число асимметрических центров.
Так, один асимметрический атом углерода есть у глицеринового альдегида HO−CH2−CH(OH)−C(O) HHO−CH2−CH(OH)−C(O) H, являющегося первым и единственным представителем ряда альдотриоз. Соответственно, первым и единственным представителем ряда кетотриоз является дигидроксиацетон.
У глицеринового альдегида существует два оптических изомера, поскольку в молекуле есть только один хиральный центр (n = 1. N = 2). У молекулы дигидроксикетона таких центров нет, поэому он не имеет оптических изомеров.
ОПРЕДЕЛЕНИЕИзомер, у которого на проекции гидроксильная группа у асимметрического атома расположена справа от основной цепи, называют D-изомером (лат. dexter - правый. Если гидроксил расположен слева - L-изомером (лат. laevus - левый
Рассмотрим на примере, как количество оптических изомеров зависит от числа хиральных центров
ПРИМЕРОпределить, сколько асимметрических атомов углерода и оптических изомеров имеется у следующих двух веществ? Указать асимметрические атомы углерода
соединение (1) соединение (2)
РЕШЕНИЕ3. Таутомерия (мутаротация. Для всех моносахаридов характерно явление мутаротации, т.е. Существование в циклической и нециклической формах.
Рассмотрим это явление на примере молекулы рибозы. Поскольку в пространстве углерод-углеродная цепь рибозы изогнута, то карбонильная группа располагается близко к –ОН группе четвертого или пятого атома углерода. Происходит взаимодействие этих двух групп одной молекулы и цикл замыкается с образованием внутреннего полуацеталя.
Вновь образовавшийся гидроксил (выделен на рис. Синим цветом носит название полуацетального, или гликозидного и может по разному располагаться в пространстве относительно цикла. Если полуацетальный гидроксил располагается по одну сторону с гидроксилом, определяющим принадлежность к D- или L-ряду, то такой изомер называется αα-изомером, если по разные стороны – ββ-изомером. Циклическая и открытая формы легко переходят друг в друга и находятся в динамическом равновесии. При комнатной температуре преобладает циклическая, при нагревании – открытая форма.
Аналогично происходит и с углеродным скелетом глюкозы: карбонильная группа располагается близко к –ОН группе пятого или шестого атома углерода, в результате чего происходит взаимодействие этих групп, приводящее к образованиюполуацетальной группы (выделена синим цветом. На рисунке ниже приведены открытая и закрытая форма существования глюкозы:
Согласно теории А. Байера:
Написать общие формулы гомологических рядов. А) алканы, б) алкены в) спирты г) карбоновые кислоты. Привести по два-три примера представителей каждого ряда (полуразвернутые формулы).
A) CnH2n+2
CH4 - метан,
С2Н6 - этан,
С4Н10 - бутан
б СnH2n
C2Н4 - этен (этилен,
С3Н6 - пропен,
С5Н10 - пентен
в CnH2n+1OH или CnH2n+2O
С2Н5ОН - этиловый спир, этанол;
СН3ОН - метиловый спирт, метанол
г CnH2nO2
CH3COOH или C2H4O2 - уксусная кислота, этановая кислота
CH3CH2COOH или C3H6O2 - пропановая кислота
Укажите общую формулу для гомологического ряда карбоновых кислот
ОБЩАЯ ФОРМУЛА КАРБОНОВЫХ КИСЛОТ:
R-COOH или CnH2n+1-COOH
Например,
метановая (муравьиная) кислота HCOOH
этановая (уксусная) кислота CH₃COOH
пропановая (пропионовая) кислота CH₃-CH₂-COOH
бутановая (масляная) кислота CH₃-CH₂-CH₂-COOH
(1) Выберите общую формулу гомологического ряда алканов
а. СnH2n+2; б. СnH2n; в. CnH2n-2; г. CnH2n-6
(2) Укажите кратность связей между атомами карбона в молекуле этена
а. Одинарные; б. Двойные; в. Тройные; г. Двое двойных
(3) Выберите тип реакции, характерный для алкинов
а. Замещения; б. Замещения; в. Замещения и присоединения; г. Другой ответ
(4) Укажите физические качества этена
а. Газ без цвета, почти без запаха, чуть легче воздуха, не растворяется в воде
б. Газ с характерным запахом, легче воздуха, плохо растворяется в воде
в. Газ без цвета и запаха, тяжелее воздуха, плохо растворяется в воде
г. Газ без цвета и запаха, легче воздуха, растворяется в воде
(5) Химические свойства этена определяется наличием связи.
а. Одинарной; б. Двойной; в. Тройной; г. Двух двойных связей
(6) Укажите внешние изменения, которые происходят при пропускании этена сквозь бромную воду
а. Бромная вода обесцвечивается
б. Цвет бромной воды не меняется
в. Бромная вода меняет свой цвет на красный
г. Бромная вода меняет свой цвет на синий
(7) Укажите, для чего в лаборатории можно использовать реакцию взаимодействия углеводородов с бромной водой
а. Определения ненасыщенных углеводородов
б. Добывания растворителей
в. Добывания бромпроизводных
г. Определения алканов
(8) Выберите утверждение, которое отражает сущность реакции полимеризации
а. Образуются высокомолекулярные соединения с выделением побочных низкомолекулярных продуктов
б. Образуются высокомолекулярные соединения без выделения побочных низкомолекулярных продуктов
в. Образуются продукты замещения атомов водорода на разные атомы и группы атомов
г. Образуются низкомолекулярные соединения с выделением побочных высокомолекулярных продуктов
(9) Выберите слово, пропущенное в предложении "Органические вещества имеют. Строение
а. Атомное; б. Молекулярное; в. Ионное; г. Не молекулярное
(10) Выберите правильное окончание предложения: "Вещества, имеющие подобное строение и свойства, но отличаются по составу молекулы на группу атомов -СН2- называют. "
а. Гомологами; б. Основами; в. Кислотами; г. Солями
(11) Укажите вещества, взаимодействующие с метаном
а. Водород; б. Вода; в. Хлор; г. Кислород
(12) Составьте уравнение реакции взаимодействия этина с избытком водорода и укажите сумму коэффициентов
(13) Выберите представителей гомологического ряда алканов и разместите их в ряд по увеличению числа атомов карбона в молекулах
а. СН4; б. С2Н4; в. С2Н2; г. СО2; д. С8Н18; е. С6Н14; ж. С3Н8; з. С2Н5ОН
(14) Установите соответствие между классом, химической формулой и названием углеводорода.
Класс: Формула: Название:
а Алкан 1) С2Н4 I) Этан
б Алкин 2) С2Н6 II) Этен
в Алкен 3) С2Н2 III) Метан
4) С6Н6 IV) Этин
(15) Завершите уравнение реакции, назовите продукты
а. СН≡СН+Н2
б. СН≡СН+2Н2
(16) Вычислите объем воздуха, необходимый для сжигания метана объемом 20 л (н.у. Объемная часть кислорода в воздухе - 20%
(1) а. СnH2n+2; (2) б. Двойные; (3) в. Замещения и присоединения; ВОПРОС НЕ ОДНОЗНАЧНЫЙ (4) а. Газ без цвета, почти без запаха, чуть легче воздуха, не растворяется в воде (5). Б. Двойной; (6) а. Бромная вода обесцвечивается (7) Укажите, для чего в лаборатории можно использовать реакцию взаимодействия углеводородов с бромной водой а. Определения ненасыщенных углеводородов в. Добывания бромпроизводных (8) Выберите утверждение, которое отражает сущность реакции полимеризации б. Образуются высокомолекулярные соединения без выделения побочных низкомолекулярных продуктов (9) Выберите слово, пропущенное в предложении "Органические вещества имеют. Строение б. Молекулярное; (10) Выберите правильное окончание предложения: "Вещества, имеющие подобное строение и свойства, но отличаются по составу молекулы на группу атомов -СН2- называют. " а. Гомологами; (11) Укажите вещества, взаимодействующие с метаном в. Хлор; г. Кислород (12) Составьте уравнение реакции взаимодействия этина с избытком водорода и укажите сумму коэффициентов C2H2 + 2H2 -> C2H6. 4 (13) Выберите представителей гомологического ряда алканов и разместите их в ряд по увеличению числа атомов карбона в молекулах а. СН4; ж. С3Н8; е. С6Н14; д. С8Н18; е. С6Н14; (14) Установите соответствие между классом, химической формулой и названием углеводорода. Класс: Формула: Название: а Алкан 2) С2Н6 I) Этан б Алкин3) С2Н2 IV) Этин в Алкен 1) С2Н4II) Этен (15) Завершите уравнение реакции, назовите продукты а. СН≡СН+Н2 -> С2Н4 Этен б. СН≡СН+2Н2 -> С2Н6 Этан (16) Вычислите объем воздуха, необходимый для сжигания метана объемом 20 л (н.у. Объемная часть кислорода в воздухе - 20% CH4 +2 O2 = CO2 + 2H2O V = 20*2*5= 200 л
Какие соединения относят к альдегидам? Приведите 5 гомологов ряда альдегидов
Альдегиды - вещества, у которых карбонильная группа (-С = О связана с углеводородным остатком (R) и атомом водорода (H).
Гомологический ряд:
НСНО - метаналь, формальдегид;
СН3СНО - этаналь, ацетальдегид;
СН3СН2СНО (С2Н5СНО - пропаналь;
СН3СН2СН2СНО (С3Н7СНО - бутаналь;
СН3СН2СН2СН2СНО (С4Н9СНО - пентаналь.
Составь 4 формулы изомеров шестого гомолога гомологического ряда алканов
CH3-CH2-CH2-CH2-CH2-CH3. Собственно, сам гексан
CH3-CH(CH3)-CH2-CH2-CH3. 2-метилпентан
CH3-CH2-CH(CH3)-CH2-CH3. 3-метилпентан
CH3-CH(CH3)-CH(CH3)-CH3, 2,3-диметилбутан
CH3-C(CH3)2-CH2-CH3. 2,2-диметилбутан
Выведите общую формулу гомологического ряда одноатомных фенолов
Формула гомологического ряда одноатомных фенолов: CnH2n–7OH n = 6,7,8… о-метилфенол, о-метилгидроксибензол, о-крезол фенол, гидроксибензол
3 Свойства фенола определяются строением гидроксильной группы, характером ее химических связей, строением углеводородного радикала и их взаимным влиянием. Связи О–Н и С–О - полярные ковалентные. Строение гидроксильной группы
4 Заряды на атомах в молекуле фенола
6 Химические свойства Кислотные свойства у фенола выражены сильнее, чем у алифатических спиртов:
9 В качестве кислоты фенол может взаимодействовать не только с щелочными металлами, но и со щелочами: фенолят натрия
10 Гидроксильная группа является ориентантом I рода. Реакции S E для фенола протекают легче, чем для бензола:
11 Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол Галогенирование
12 Методы получения 1. Щелочной гидролиз галогенаренов
13 2. Сплавление солей сульфокислот со щелочами серная кислота бензолсульфокислота натриевая соль бензолсульфокислоты Арен+
1)+ Cl2
2)+NaOH/H2O
-> фенол
Формула гомологического ряда одноатомных фенолов: CnH2n–7OH n = 6,7,8… о-метилфенол, о-метилгидроксибензол, о-крезол фенол, гидроксибензол
3 Свойства фенола определяются строением гидроксильной группы, характером ее химических связей, строением углеводородного радикала и их взаимным влиянием. Связи О–Н и С–О - полярные ковалентные. Строение гидроксильной группы
4 Заряды на атомах в молекуле фенола
6 Химические свойства Кислотные свойства у фенола выражены сильнее, чем у алифатических спиртов:
9 В качестве кислоты фенол может взаимодействовать не только с щелочными металлами, но и со щелочами: фенолят натрия
10 Гидроксильная группа является ориентантом I рода. Реакции S E для фенола протекают легче, чем для бензола:
11 Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол Галогенирование
12 Методы получения 1. Щелочной гидролиз галогенаренов
13 2. Сплавление солей сульфокислот со щелочами серная кислота бензолсульфокислота натриевая соль бензолсульфокислоты