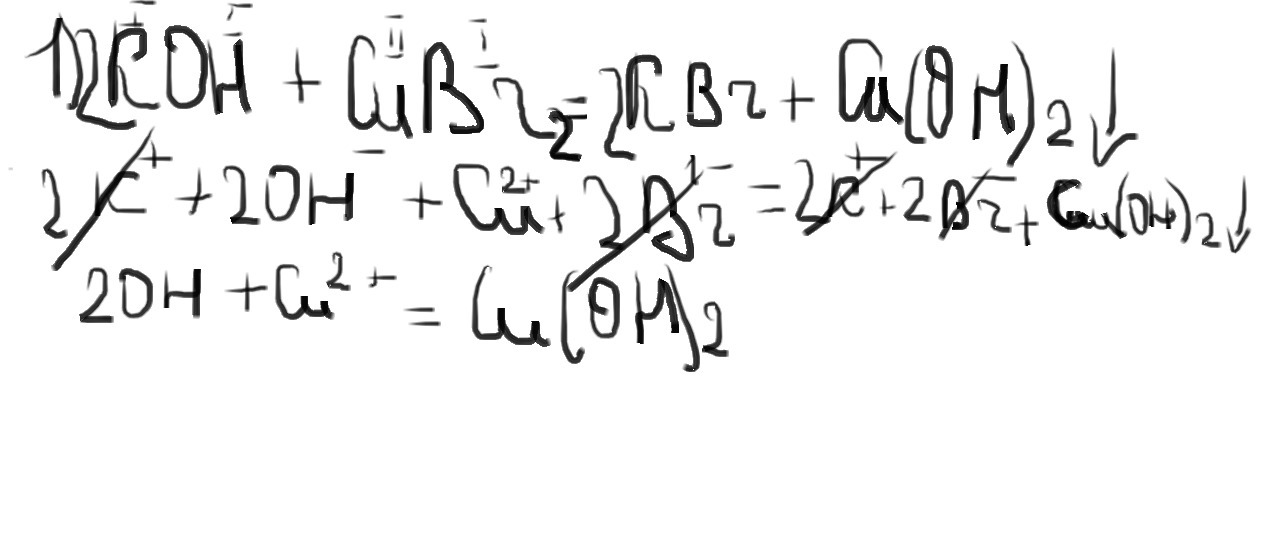Реакции ионного обмена - задачи и примеры
Даны вещества Ag, H2SO4(разб. ), CuO, Fe, NaOH,(CuOH)2CO3.
Используя воду и необходимые вещества только из этого списка, получите в две стадии медь. Опишите признаки проводимых реакций. Для реакции ионного обмена напишите сокращенное ионное уравнение
1. Fe + H2SO4(разб. ) = FeSO4 + H2
Происходит растворение железа с образованием бесцветного газа
2. CuO + H2 = Cu(стрелка вниз+ H2O
Образование красно-кирпичной меди
Здесь нет реакций ионного обмена.
Составьте уравнения соответствующих реакций. Реакции ионного обмена запишите так же в ионной форме.
CuSO4-> Cu(OH)2-> CuO-> Cu
,
MgCO3->MgCl2->Mg(OH)2->MgSO4
-
MgO+CO2->MgCO3 (Реакция протекает не в растворе
MgCO3+2HCl->MgCl2+CO2+H2O (MgCO3 - гидролизуется в растворе
Mg(2+)+CO3(2-)+2H(+)+2Cl(-)->Mg(2+)+2Cl(-)+CO2+H2O (полное ионное уравнение
CO3(2-)+2H(+)->CO2+H2O (малое ионное уравнение "сокращенное")
MgCl2+2NaOH->Mg(OH)2+2NaCl (молекулярное уравнение
Mg(2+)+2Cl(-)+2Na(+)+2OH(-)->Mg(2+)+2OH2(-)+2Na(+)+2Cl(-) (полное ионное уравнение
Mg(2+)+2OH(-)->Mg(OH)2 (малое ионное уравнение "сокращенное")
Mg(OH)2+H2SO4->MgSO4+2H2O (молекулярное уравнение
Mg(2+)+2OH(-)+2H(+)+SO4(2-)->Mg(2+)+SO4(2-)+2H2O (полное ионное уравнение
2OH(-)+2H(+)->2H2O (малое ионное уравнение "сокращенное")
Задание 1.
Составьте молекулярное, полное и сокращенное ионное уравнения для реакций между: гидроксидом калия и бромидом меди(II).
Задание 2.
Между какими веществами реакции ионного обмена протекают до конца (ответ поясните: а гидроксидом натрия и хлоридом меди (II); б карбонатом натрия и соляной кислотой; в хлоридом кальция и хлоридом меди (II); г сульфатом бария и карбюонатом натрия?
1)$$ Ca(OH)_2 + CuCl_2 = CaCl_2 + Cu(OH)_2 $$ - реакция идет до конца, так как выпадает осадок
1)
2) a) 2NaOH + CuCl2 = 2NaCl + Cu(OH)2 (осадок
2Na(+)+ 2OH(-) + Cu(2+) + 2Cl (-)= 2Na(+)+ 2Cl(-) + Cu(OH)2 (осадок
2OH(-)+ Cu (2+) = Cu(OH)2
b) Na2Co3 + 2HCl= 2NaCl + H2Co3
2Na(+)+Co3(2-)+ 2H(+)+ 2Cl(-)= 2Na(+)+2Cl(-)+ H2O+ Co2(газ(стрелочка вверх
Co3(2-)+ 2H(+)=H2O + Co2
с CaCl + CuCl2= обратимая реакция, єто 2 противоположніе стрелочки
в 2BaSO4+ 2NaCo3= 2BaCO3 (осадок+ Na2SO4
2BaSo4+ 2Na(+)+ 2CO3(2-)= 2BaCO3(осадок+ 2Na(+) + SO4(2-)
Далее Только Na сокращается, и происходит реакция замещения.
2BaSO4+ 2CO3(2-)= 2BaCO3(осадок+ 2So4(2-)
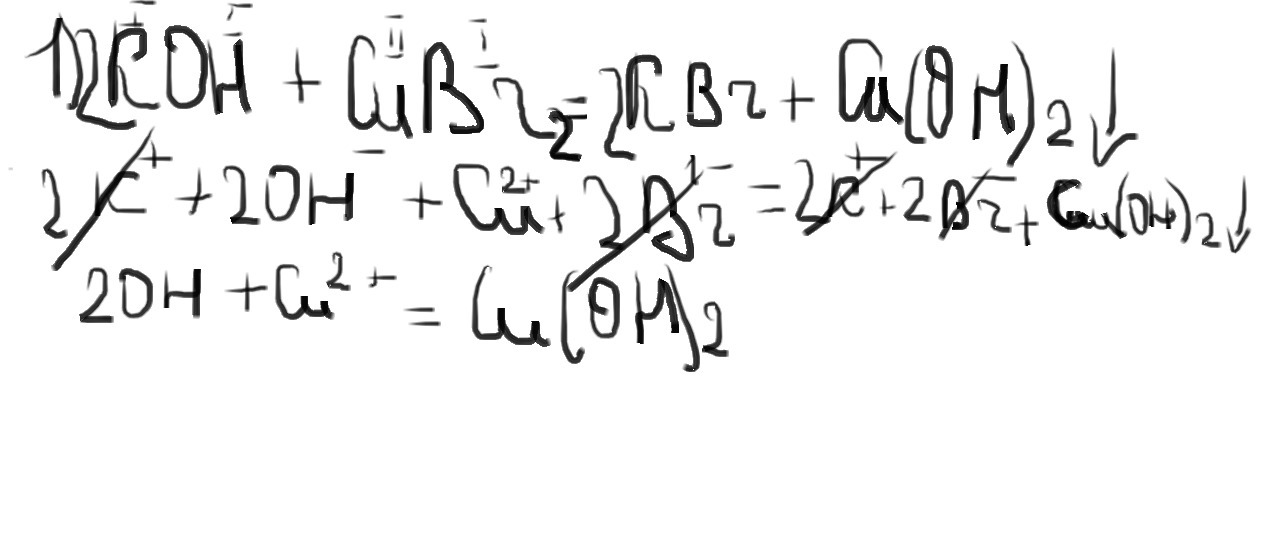
1. Составьте электронную схему атома, электронную и графическую формулу для химического элемента с порядковым номером 19, с помощью которой дайте ответы на следующие вопросы:
1) положение в периодической системе (период, группа, подгруппа.
2 ) количество электронов на внешнем энергетическом уровне.
3) высшая степень окисления, формула высшего оксида, его характер и название.
2. Составить уравнения химических реакций и показать их как окислительно - восстановительные.
А Ba + H2O → Б Al + Fe2O3 →
3. Расставить коэффициенты в схеме реакции методом электронного баланса:
Cu + HNO3 → Cu(NO3)2 + NO + H2O
4. Составить уравнения химических реакций и показать их как реакции ионного обмена:
1) Cu(OH)2 + HNO3 → 2) NaCl + AgNO3 →
5. Осуществить следующие превращения: Fe → FeCl2 → Fe(OH)2 → FeO → FeSO4
Задача. Какой объём водорода выделится, если 10 г. Натрия поместить в воду массой 7,2 г.
N19 K-калий
2е8е8е1е 1s22s2p63s2p64s1
а3 большой период, 1 группа, главная подгруппа.
б 1е
в +1 K2O-оксид калия, основный
г KOH-гидроксид калия, основание
дK более сильный восстановить, чем кальций
2)
аBa+2H2O = Ba(OH)2+H2
б2Al+V2O5 = Al2O3+2V
3)3 Cu+8HNO3 = 3Cu(NO3)2+2NO+4H2O
4) Cu(OH)2+2HNO3 = Cu(NO3)2+2H2O
NaCl+AgNO3 = AgCl+NaNO3
5) Fe+2HCl = FeCL2+H2
FeCL2+2NaOH = Fe(OH)2+2NaCL
Fe(OH)2 = FeO+H2O
FeO+H2SO4 = FeSO4+H2O
Задание1: написать реакции ионного обмена для следующих пар веществ
А нитрат серебра и хлорид калия
Б гидроксид натрия и соляная кислота
В сульфат цинка и гидроксид калия
Г хлорид бария и сульфат натрия
Д сульфид железа (II) и серная кислота
Задание 2. Сколько г осадка выпадет при взаимодействии 13,5 г хлорида
меди (II) с гидроксидом натрия?
1) AgNO3 + KCl = AgCl + KNO3
Ag(+) + NO3(-) + K(+) + Cl(-) = AgCl + K(+) + NO3(-)
Ag(+) + Cl(-) = AgCl
NaOH + HCl = NaCl + H2O
Na(+) + OH(-) + H(+) + Cl(-) = Na(+) + Cl(-) + H2O
H(+)+ OH(-) = H2O
ZnSO4 + 2KOH = Zn(OH)2 + K2SO4
Zn(+2) + SO4(-2) + 2K(+) + 2OH(-) = Zn(OH)2 + 2K(+) + SO4(-2)
Zn(+2) + 2OH(-) = Zn(OH)2
BaCl2 + Na2SO4 = BaSO4 + 2NaCl
Ba(+2) + 2Cl(-) + 2Na(+) + SO4(-2) = BaSO4 + 2Na(+) + 2Cl(-)
Ba(+2) + SO4(-2) = BaSO4
FeS + H2SO4 = FeSO4 + H2S
FeS + 2H(+) + SO4(-2) = Fe(+2) + SO4(-2) + H2S
FeS + 2H(+) = Fe(+2) + H2S
2) 13,5 г Х г
CuCl2 + 2NaOH = Cu(OH)2 + 2NaCl
n = 1 моль n = 1 моль
Mr = 133,5 г/моль Mr = 97,5 г/моль
m = 133,5 г m = 97,5 г
13,5 г CuCl2 - Х г Cu(OH)2
133,5 г CuCl2 - 97,5 г Cu(OH)2
m(Cu(OH)2) = 13,5 * 97,5 / 133,5 = 10 г
Между какими веществами реакции ионного обмена протекают до конца (ответ поясните:
А. Хлоридом натрия и гидроксидом калия;
Б. Карбонатом калия и азотной кислотой;
В. Гидроксидом кальция и хлоридом меди (II);
Г. Сульфатом бария и силикатом натрия.
А NaCl + KOH - реакция не протекает до конца, ИЗ-ЗА ТОГО ЧТО НЕ ВЫПАДАЕТ ОСАДОК, не выделяется газ, не образуется малодиссоциирующее вещество (т. Е не выполняется ни одно условие ионного обмена
б K2CO3 + 2HNO3 = 2KNO3 + CO2 +H2O - реакция идет до конца, так как выделяется газ
в Ca(OH)2 + CuCl2 = CaCl2 + Cu(OH)2 - реакция идет до конца, так как выпадает осадок
г BaSO4 + Na2SiO3 - реакция ионного обмена невозможна, так как сульфат бария - нерастворимая соль.
Между какими веществами реакции ионного обмена протекают до конца (ответ поясните: а хлоридом натрия и гидроксидом калия; б карбонатом калия и азотной кислотой; в гидроксидом кальция и хлоридом меди (II); г сульфатом бария и силикатом натрия?
А NaCl + KOH - реакция не протекает до конца, так как в результате реакции не выпадает осадок, не выделяется газ, не образуется малодиссоциирущее вещество (то есть не выполняется ни одно условие ионного обмена
б K2CO3 + 2HNO3 = 2KNO3 + CO2 +H2O - реакция идет до конца, так как выделяется газ
в Ca(OH)2 + CuCl2 = CaCl2 + Cu(OH)2 - реакция идет до конца, так как выпадает осадок
г BaSO4 + Na2SiO3 - реакция ионного обмена невозможна, так как сульфат бария - нерастворимая соль, а в реакции могут участвовать только растворы солей.
решите первые десять уравнений реакции ионного обмена
2HCl + Na₂CO₃ = 2NaCl + CO₂ + H₂O
HCl + AgNO₃ = HNO₃ + AgCl
H₂SO₄ + BaCl₂ = 2HCl + BaSO₄
K₃PO₄ + 3AgNO₃ = 3KNO₃ + Ag₃PO₄
K₂SO₃ + 2HCl = 2KCl + H₂SO₃
NH₄Cl + NaOH = NaCl + NH₃ + H₂O
CuSO₄ + 2KOH = K₂SO₄ + Cu(OH)₂
FeCl₃ + 3NaOH = 3NaCl + Fe(OH)₃
K₂SiO₃ + 2HCl = 2KCl + H₂SiO₃
KOH + HCl = KCl + H₂O
1. Одно из условий, при котором реакции ионного обмена идут до конца
1) образование осадка
2) выделение тепла
3) изменение цвета
4) образование запаха
5) испарение воды
Это ответ 1) образование осадка. Потому что осадок не растворим, а это значит, что на ионы он почти не диссоциирует, что является хорошим условием для реакций ионного обмена идти до конца.
Решите уравнение:
-Допишите уравнения реакций.
-Расставьте коэффициенты.
-Определите тип реакций.
для реакции ионного обмена запишите полное и краткое ионные уравнения.
1) Al+S = Al2S3
2) Cu(OH)2 =
3) H2SO4+KOH =
4) Fe+AgNO3= Fe(NO3)2+Ag
2Al + 3S = Al2S3 ( реакция соединения
Cu(OH)2 -> CuO + H2O ( реакция разложения
H2SO4 + 2KOH = K2SO4 + 2H2O ( реакция обмена
2H(+) + SO4(-2) + 2K(+) + 2OH(-) = 2K(+) + SO4(-2) + 2H2O
2H(+)+ 2OH(-) = 2H2O
Fe + 2AgNO3 = Fe(NO3)2 + 2Ag (реакция замещения