Строение атомов метала
Атом - состоит из положительного заряженного ядра,

Атом - состоит из положительного заряженного ядра,

Атомная масса 55,847
порядковый номер железа26 = заряд ядра = количество протонов
56-26 = 30 количество нейтронов
количество протонов = количеству электронов = 26
строение атома: Fe +26 )2 )8 )14 )2.
электронная формула железа 1s2 2s2 p6 3s2 p6 4s2 3d6.
1) N Протоны=7
Электроны=7
Нейтроны=14-7 = 7
2) Eu Протоны=63
Электроны=63
Нейтроны=152-63 = 89
3) Ne Протоны=10
Электроны=10
Нейтроны=20-10 = 10
4) Ti Протоны=22
Электроны=22
Нейтроны=48-22 = 24
5) Na Протоны=11
Электроны=11
Нейтроны=23-11 = 12
6) Sn Протоны=50
Электроны=50
Нейтроны=119-50 = 69
7) Se Протоны=34
Электроны=34
Нейтроны=79-34 = 45
8) Te Протоны=52
Электроны=52
Нейтроны=128-52 = 76
1.Na-Mg-Al слева направо металлические свойства усиливаются
2.NH3- ковал. Полярная, MgO-ионная, I2- ковалентная непол. Na-металлическая
3. Приложение
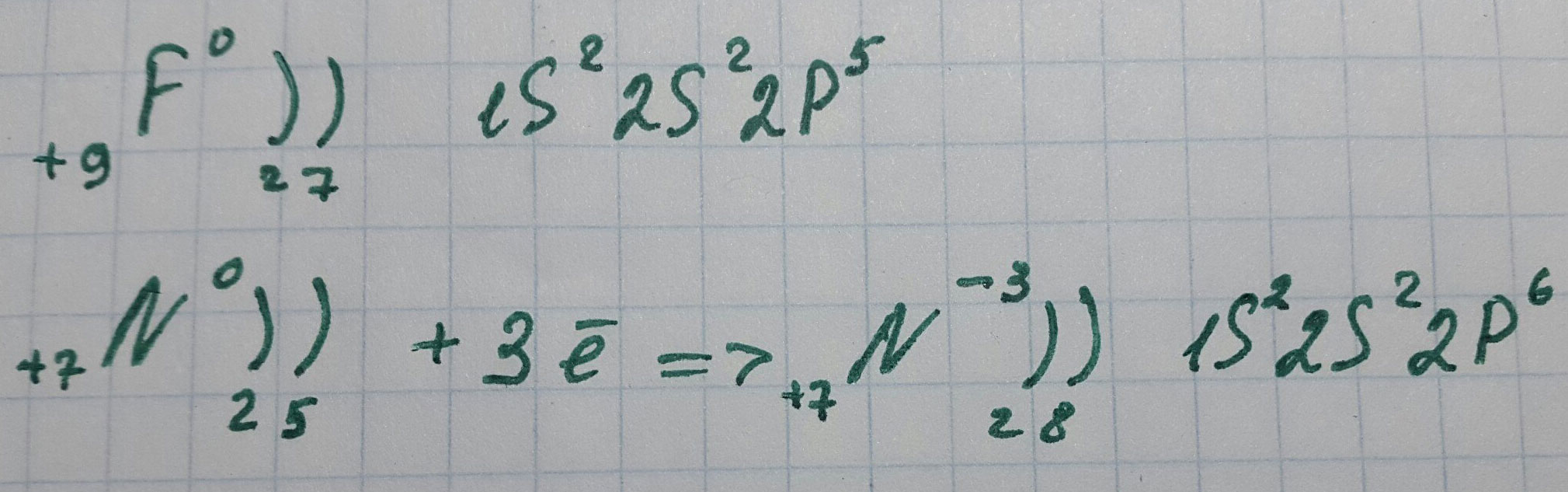
В Бора +5 в Вуглецю +6 в них рівні відрізняються в періоді в бора закінчений період а в вуглецю період переходить на p рівень

Восстановительные свойства металлов определяются способностью отдавать электроны внешнего слоя. Чем легче атом отдает электроны внешнего слоя, тем более сильным восстановителем он является.