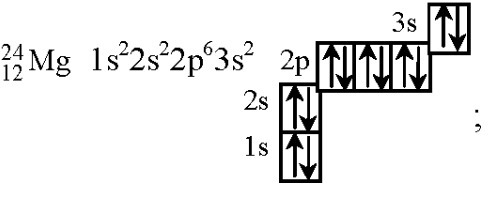Электронное строение атома - задачи и примеры
Строение атомов неметаллов
У атомов неметаллов внешняя электронная оболочка содержит много ( от 4 до 7) электронов ( исключение атом гелия, у которого 2 электрона и стремится к завершению либо путем принятия недостающих электронов (тогда неметалл - окислитель, либо путем отдачи электронов ( тогда неметалл - восстановитель. Если на внешней электронной оболочке 8 электронов это инертный газ.
Как определить строение атома по таблице Менделеева
По номеру элемента можно определить количество электронов и протонов, а чтобы найти количество нейтронов нужно от массы отнять порядковый номер. По номеру периода можно определить количество электронных оболочек, а по номеру группы число валентных электронов (число электронов на последней оболочке
Сравните строение атомов химических элементов с порядковыми номерами 15 и 33
P и As находятся в группе азота Стоят в 5 группе, поэтому на внешнем электронном слое 5 электронов. Находятся в разных периодах P в 3 а As в 4. Оба являются не металлами. У фосфара больше электроотрицательность поэтому будет вытеснять мышьяк из соединения (р-ция замещения
Написать электронное строение атома от номера 12 до 18
12 Магний Mg(+12) )2e )8e )2e 1s2 2s2 2p6 3s2
13 Алюминий Al(+13) )2e )8e )3e 1s2 2s2 2p6 3s2 3p1
14 Кремний Si(+14) )2e )8e )4e 1s2 2s2 2p6 3s2 3p2
15 Фосфор P(+15) )2e )8e )5e 1s2 2s2 2p6 3s2 3p3
16 Сера S(+16) )2e )8e )6e 1s2 2s2 2p6 3s2 3p4
17 Хлор Cl(+17) )2e )8e )7e 1s2 2s2 2p6 3s2 3p5
18 Аргон Ar(+18) )2e )8e )8e 1s2 2s2 2p6 3s2 3p6
Написать электронное строение атома Mg
На картинке изображено распределение электронов по атомным орбиталям и его электронная конфигурация.
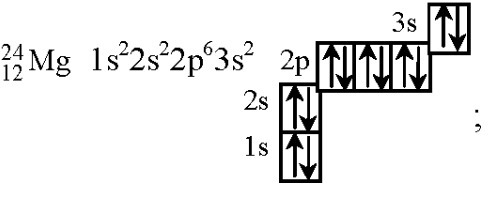
Сравните строение атомов натрия и магния, заряд ядра, количество энергетических уровней, количество электронов на последнем энергетическом уровне, радиус атома.
Заряд ядра (порядковый номер)
Na(+11) ) ) ) Mg(+12) ) ) )
2 8 1 2 8 2
Находятся в 3 периоде следовательно у них три эн. уровня (n = 3)
Внешний эн. Уровень у Na содержит 1 e (валентный электрон) Внешний эн. Уровень у Mg содержит 2 e (валентные электроны )
Радиус уменьшается с увеличением атомной массы