Напишите строение атома Bh(бория)
Электронная конфигурация - 1s²2s²2p⁶3s²3p⁶4s²3d¹⁰4p⁶5s²4d¹⁰5p⁶6s²4f¹⁴5d¹⁰6p⁶7s²5f¹⁴6d⁵
Электронная конфигурация - 1s²2s²2p⁶3s²3p⁶4s²3d¹⁰4p⁶5s²4d¹⁰5p⁶6s²4f¹⁴5d¹⁰6p⁶7s²5f¹⁴6d⁵

А) Литий является щелочным металлом, однако относительно устойчив на воздухе. Литий является наименее активным щелочным металлом, с сухим воздухом (и даже с сухим кислородом при комнатной температуре практически не реагирует. По этой причине литий является единственным щелочным металлом, который не хранят в керосине (к тому же плотность лития столь мала, что он будет в нём плавать; он может непродолжительное время храниться на воздухе
б) При нагревании на воздухе магний сгорает с образованием оксида и небольшого количества нитрида. При этом выделяется большое количество теплоты и световой энергии: Применяется для восстановления металлического титана из тетрахлорида титана. Используется для получения лёгких и сверхлёгких сплавов (самолётостроение, производство автомобилей, а также для изготовления осветительных и зажигательных ракет.
в) При нормальных условиях алюминий покрыт тонкой и прочной оксидной плёнкой и потому не реагирует с классическими окислителями: с H2O (t°), O2, HNO3(без нагревания. Благодаря этому алюминий практически не подвержен коррозии и потому широко востребован современной промышленностью.
Li- 2s^1
B- 2s^2
Si-3s^2,3p^2
Na-3s^1
Hg- 5d^10,6s^2
Zn- 3d^10,4s^2
C-2s^2,2p^2
Ac-6d^1,7s^2
(^2 и т. д-в квадрате
Атом состоит из атомного ядра и электронной оболочки.
Ядро атома состоит из протонов (p+) и нейтронов (n0). У большинства атомов водорода ядро состоит из одного протона.
Число протонов N(p+) равно заряду ядра (Z) и порядковому номеру элемента в естественном ряду элементов (и в периодической системе элементов. N(p+) = ZСумма числа нейтронов N(n0), обозначаемого просто буквой N, и числа протонов Zназывается массовым числом и обозначается буквой А. A = Z + NЭлектронная оболочка атома состоит из движущихся вокруг ядра электронов (е-).
Число электронов N(e-) в электронной оболочке нейтрального атома равно числу протоновZ в его ядре.
Масса протона примерно равна массе нейтрона и в 1840 раз больше массы электрона, поэтому масса атома практически равна массе ядра.
Форма атома - сферическая. Радиус ядра примерно в 100000 раз меньше радиуса атома.
Химический элемент - вид атомов (совокупность атомов с одинаковым зарядом ядра (с одинаковым числом протонов в ядре.
Изотоп - совокупность атомов одного элемента с одинаковым числом нейтронов в ядре (или вид атомов с одинаковым числом протонов и одинаковым числом нейтронов в ядре.
Разные изотопы отличаются друг от друга числом нейтронов в ядрах их атомов.
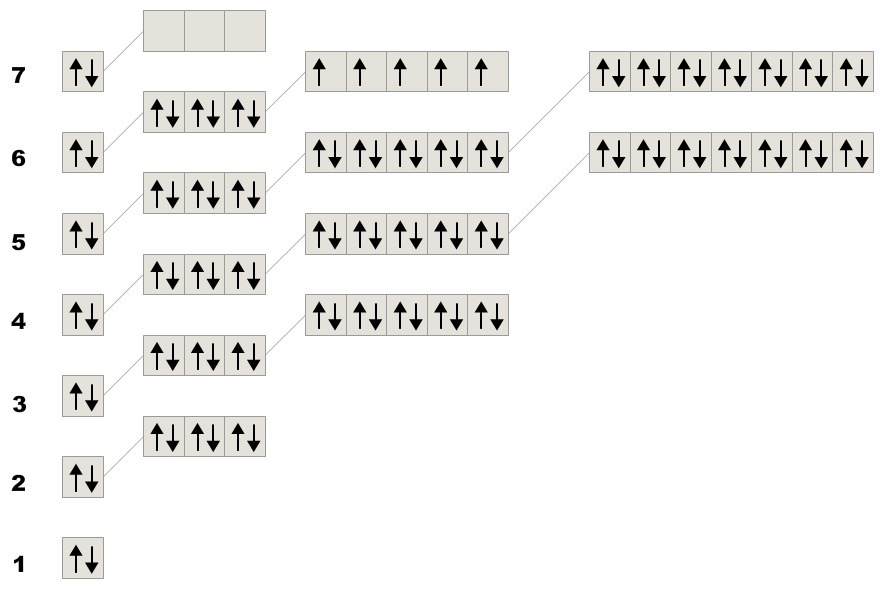
нормальное строение кремния соответствует валетному состоянию II, так как кремний на последнем энергетическом уровне имеет 2 неспаренных электрона (3р2). электроны с 3s2 перейдя на соседний подуровень 3р распариваются (становится 4 неспаренных электрона и валентность кремния проявляется как IV.
Схемы во электронно-графического строения атома кремния и валентных состояний во вложении:

1. Золото
2. Ртуть
3, 4, 5. Скандий, Галлий, Германий
6. Рутений
7. Хром
8. Астат
9. Серебро
10. Кислород
11. Углерод
12. Водород
13. Алюминий
14. Калий
15. Технеций
16. Индий
17. Натрий
18. Гелий
19. Литий
20. Олово
21. Селен
22. Медь
23. Платина
24. Бор
25. Фтор
26. Церий