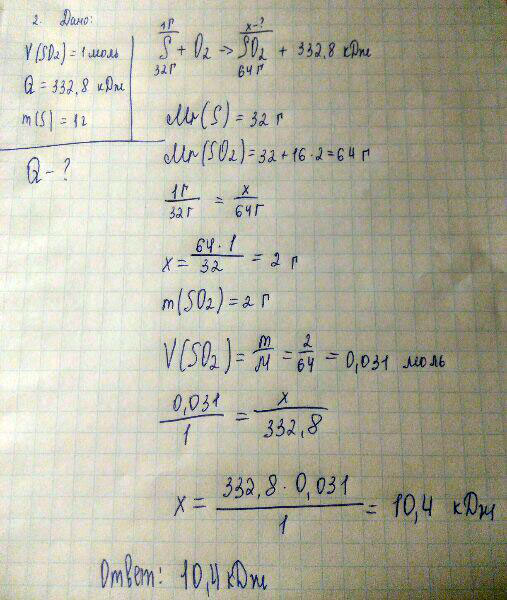Простые вещества - задачи и примеры
Какая масса серы затратится на получение 128 г оксида серы (IV) из простых веществ?
Х г 128 г
S + O2 -> SO2
n = 1 моль n = 1 моль
М = 32 г/моль М = 64 г/моль
m = 32 г m = 64 г
Х г S - 128 г SO2
32 г S - 64 г SO2
m(S) = 32 * 128 / 64 =64 г
Задание 1.
Вычислите объем кислорода (н.у.), который потребуется для сгорания 62 г фосфора, если образуется оксид фосфора(V)?
Задание 2.
Какая масса серы затратится на получение 12,8 г оксида серы(IV) из простых веществ?
1)
Дано:
m(P) = 62 г
Найти:
V(O2)=?
4P + 5O2 = 2P2O5
M(P) = 31 г/моль
n(P) = m(P)/M(P)
n(P) = 62 г/31 г/моль = 2 моль
Vm = 22,4 л/моль
Из УХР следует, что n(O2) = ⁵/₄n(P) =⁵/₄*2 моль= 2,5 моль
V(O2) = n(O2)*Vm
V(O2) = 2,5 моль*22,4 л/моль = 56 л
Ответ: 56 л
2)
Дано:
m(SO₂) = 12.8 г
Найти:
m(S)=?
S + O₂ = SO₂
M(S) = 32 г/моль
M(SO₂) = 64 г/моль
n(SO₂) = m(SO₂)/M(SO₂) =12,8 г/64 г/моль = 0,2 моль
Из УХР следует, что n(S)=n(SO₂) = 0,2 моль
m(S)= n(S)*M(S)
m(S) = 0,2 моль*32 г/моль = 6,4 г
Ответ: 6,4 г
Дайте характеристику элемента Кислород по плану:
План:
1. Положение элемента в Периодической системе и строение его атомов.
2. Характер простого вещества (металл, неметалл, переходный металл.
3. Сравнение свойств простого вещества со свойствами простых веществ, образованных соседними по подгруппе элементами.
4. Сравнение свойств простого вещества со свойствами простых веществ, образованных соседними по периоду элементами.
5. Состав высшего оксида
6. Состав высшего гидроксида
1. Кислород стоит во 2 периоде и в 6 группе. У него 8 протонов, 8 электронов и 7 нейтронов.
2. Он неметалл
3. Если сравнивать с S то у кислорода радиус атома меньше, восстановительные свойства хуже, а окислительные лучше, металлические свойства хуже, неметаллические лучше.
4. Если сравнивать кислород с фтором то у кислорода радиус атома больше, восстановительные свойства лучше, окислительные хуже, металлические свойства лучше, неметаллические хуже.
5. О3
6. Н2О
1. Среди галогенов – простых веществ - твердым является
фтор
хлор
бром
иод.
2. О фторе нельзя сказать, что он
самый активный;
самый электроотрицательный;
самый агрессивный;
самый легкий элемент.
3. Наиболее ярко выражены восстановительные свойства у
фтора
хлора
брома
иода.
4. Из галогенов как отравляющее вещество в боевых действиях был применен впервые
фтор
хлор
бром
иод.
5. Степень окисления хлора в соединении Са (ОСl)2
-1
+1
+3
+5
6. Сила галогеноводородных кислот возрастает в ряду
НСl, НВr, НI;
НI, НВr, НСl;
НВr, НI, НСl;
НI, НСl, НВr.
7. При сливании растворов бромида калия и нитрата серебра образуется осадок
белого цвета;
желтоватого цвета;
желтого цвета;
оранжевого цвета.
8. Смешали два раствора, содержащие равные массы хлорида натрия и нитрата серебра по 20 г каждого. Масса выпавшего осадка равна
16,8 г
33,6 г
48,8 г
97,7 г
9. Фтор взаимодействует с водой по уравнению ______
Вариант
1
2
3
4
5
6
7
8
Ответ
4
4
4
2
2
1
2
1
t
9. 2F2 + 2H2O = 4HF + O2 10. 3Cl2 + 6KOH = 5KCl + KClO3+ 3H2O
При образовании 1 моль оксида серы (IV) из простых веществ выделяется 332,8 кДж. Сколько выделяется теплоты при сгорании 1 г серы
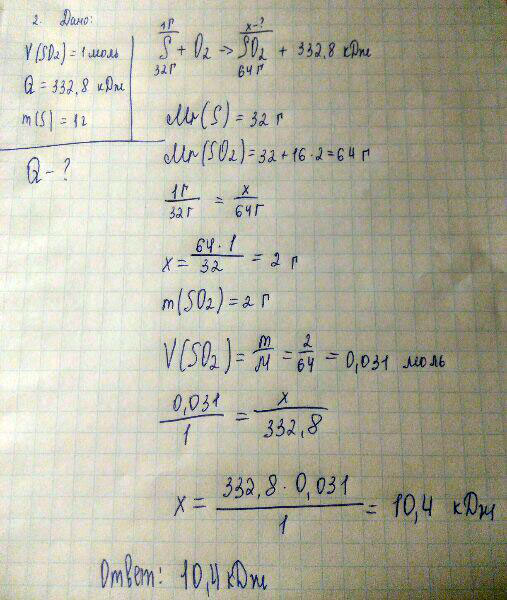
Расставьте коэффициенты в уравнениях химических реакций и укажите тип химической реакции:
CaO+P2O5= Ca3(PO4)2
NaNO3 = NaNO2+O2
Pb3O4+H2 = Pb+H2O
Al+CuCl2 = AlCl3Cu
Формулы простых веществ подчеркните одной чертой, сложных- двумя.
В CaO и CuCl2 определите валентность атомов.
1.3CaO+P2O5 = Ca3(PO4)2 -соединение
2.2NaNO3 = 2NaNO2+O2-разложение
3.Pb3O4+2H2 = 3Pb+4H2O - замещение
4.2Al+3CuCl2 = 2AlCl3+3Cu-замещение
Простые вещества:O2,H2,Al
Остальные сложные
СаO валентность и Са и О = 2
СuCl2 валентность Сu = 2; Cl2 = 1