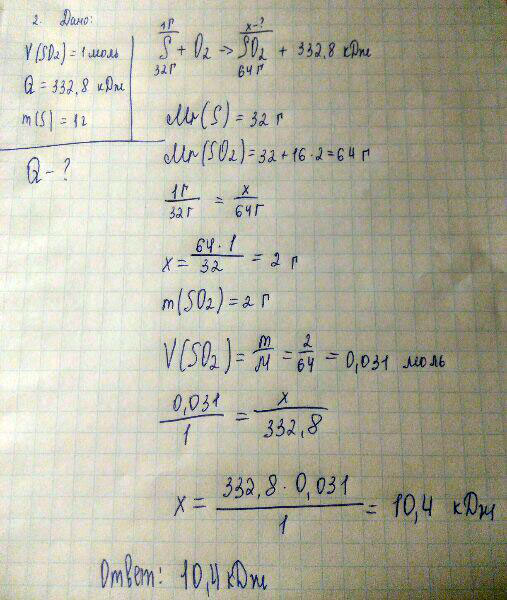Простые вещества - задачи и примеры
Дайте характеристику элемента Кислород по плану:
План:
1. Положение элемента в Периодической системе и строение его атомов.
2. Характер простого вещества (металл, неметалл, переходный металл.
3. Сравнение свойств простого вещества со свойствами простых веществ, образованных соседними по подгруппе элементами.
4. Сравнение свойств простого вещества со свойствами простых веществ, образованных соседними по периоду элементами.
5. Состав высшего оксида
6. Состав высшего гидроксида
1. Кислород стоит во 2 периоде и в 6 группе. У него 8 протонов, 8 электронов и 7 нейтронов.
2. Он неметалл
3. Если сравнивать с S то у кислорода радиус атома меньше, восстановительные свойства хуже, а окислительные лучше, металлические свойства хуже, неметаллические лучше.
4. Если сравнивать кислород с фтором то у кислорода радиус атома больше, восстановительные свойства лучше, окислительные хуже, металлические свойства лучше, неметаллические хуже.
5. О3
6. Н2О
1. Среди галогенов – простых веществ - твердым является
фтор
хлор
бром
иод.
2. О фторе нельзя сказать, что он
самый активный;
самый электроотрицательный;
самый агрессивный;
самый легкий элемент.
3. Наиболее ярко выражены восстановительные свойства у
фтора
хлора
брома
иода.
4. Из галогенов как отравляющее вещество в боевых действиях был применен впервые
фтор
хлор
бром
иод.
5. Степень окисления хлора в соединении Са (ОСl)2
-1
+1
+3
+5
6. Сила галогеноводородных кислот возрастает в ряду
НСl, НВr, НI;
НI, НВr, НСl;
НВr, НI, НСl;
НI, НСl, НВr.
7. При сливании растворов бромида калия и нитрата серебра образуется осадок
белого цвета;
желтоватого цвета;
желтого цвета;
оранжевого цвета.
8. Смешали два раствора, содержащие равные массы хлорида натрия и нитрата серебра по 20 г каждого. Масса выпавшего осадка равна
16,8 г
33,6 г
48,8 г
97,7 г
9. Фтор взаимодействует с водой по уравнению ______
Вариант
1
2
3
4
5
6
7
8
Ответ
4
4
4
2
2
1
2
1
t
9. 2F2 + 2H2O = 4HF + O2 10. 3Cl2 + 6KOH = 5KCl + KClO3+ 3H2O
При образовании 1 моль оксида серы (IV) из простых веществ выделяется 332,8 кДж. Сколько выделяется теплоты при сгорании 1 г серы
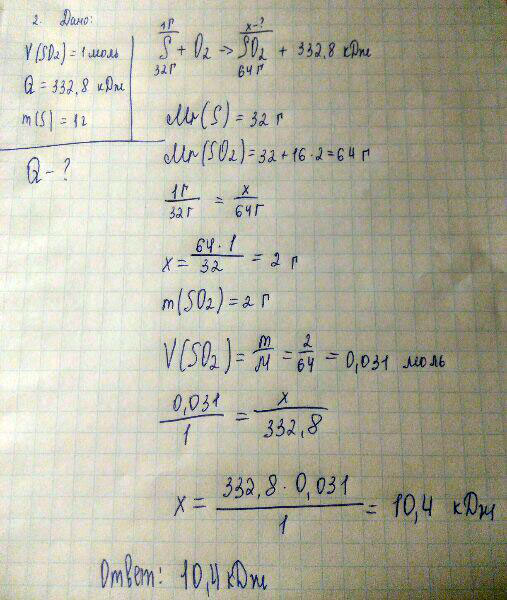
Расставьте коэффициенты в уравнениях химических реакций и укажите тип химической реакции:
CaO+P2O5= Ca3(PO4)2
NaNO3 = NaNO2+O2
Pb3O4+H2 = Pb+H2O
Al+CuCl2 = AlCl3Cu
Формулы простых веществ подчеркните одной чертой, сложных- двумя.
В CaO и CuCl2 определите валентность атомов.
1.3CaO+P2O5 = Ca3(PO4)2 -соединение
2.2NaNO3 = 2NaNO2+O2-разложение
3.Pb3O4+2H2 = 3Pb+4H2O - замещение
4.2Al+3CuCl2 = 2AlCl3+3Cu-замещение
Простые вещества:O2,H2,Al
Остальные сложные
СаO валентность и Са и О = 2
СuCl2 валентность Сu = 2; Cl2 = 1
А1. Число электронов в ионе железа Fe2+ равно:
1) 54 2) 28 3) 58 4) 24
А2. В ряду химических элементов Na Mg Al Si :
1) увеличивается число энергетических уровней
2) усиливаются металлические свойства
3) уменьшается высшая степень окисления
4) ослабевают металлические свойства
А3. Путём соединения атомов одного и того же химического элемента образуется связь:
1) ионная 3) ковалентная неполярная
2) ковалентная полярная 4) водородная
А4. Наименьшую степень окисления марганец имеет в соединении:
1) MnSO4 2) MnO2 3) K2MnO4 4) Mn2O3
А5. В каком ряду простые вещества расположены в порядке уменьшения металлических свойств?
1) Ba, Sr, Ca 2) Li, Na, K 3) Be, Mg, Ca 4) Al, Mg, Na
А6. В каком соединении все атомы углерода находятся в состоянии sp2- гибридизации?
1) СН2 = СН—СН = СН2 3) СН3 – СН2 – С СН
2) СН2 = С = С— СН 4) СН3 – С С – СН3
А7. Число протонов, нейтронов и электронов в атоме 29Si равно соответственно:
1) 14,29, 15 2) 14,15, 14 3) 14,14, 15 4) 29,15, 14
А8. Среди приведенных химических элементов самый большой атомный радиус имеет:
1) кремний 2) кальций 3) калий 4) алюминий
А9. Хлорид- иону Cl—соответствует электронная конфигурация:
1) 1s22s22p63s23p5 3) 1s22s22p63s23p6
2) 1s22s22p63s2 4) 1s22s22p63s23p4
А10. Степень окисления +3 фосфор проявляет в соединении:
1) PCl3 2) Ca3P2 3) Ca3(PO4)2 4) P2O5
А11. Химические элементы расположены в порядке увеличения электроотрицательности в ряду:
1) Ca—Cr—Rb—K 3) C—Si—N—S
2) P—S—Cl—Ar 4) Si—P—S—Cl
А12. Соединением с ионной связью является:
1) N2O 2) Cl2O 3) Na2O 4) CO2
А13. Число π- связей в молекуле бутина- 1 равно:
1) 1 2) 2 3) 3 4) 4
В1. Установите соответствие между формулой вещества и значением степени окисления атомов хлора в нём:
ФОРМУЛА ВЕЩЕСТВА СТЕПЕНЬ ОКИСЛЕНИЯ
A) HClO 1) -1
Б Cl2O7 2) 0
B) HClO4 3) +3
ГKCl 4) +1
5) +5
6) +7
В2. Установите соответствие между формулой вещества и видом связи между атомами в нём:
ФОРМУЛА ВЕЩЕСТВА ВИД СВЯЗИ
А Na 1) ковалентная неполярная
Б SO2 2) ковалентная полярная
В KCl 3) ионная
Г N2 4) металлическая
B3. Установите соответствие между формулой высшего оксида химического элемента и электронной конфигурацией внешнего энергетического уровня его атома:
ФОРМУЛА ВЫСШЕГО ОКСИДА ЭЛЕКТРОННАЯ
КОНФИГУРАЦИЯ
А R2O3 1) ns2np3
Б RO 2) ns2np2
B) R2O5 3) ns2
Г RO2 4) ns2np1
А1. Ответ 4. Как решать - открываешь таблицу Менделева, находи железо, порядковый номер соответствует колву электронов. Заряд 2+ говорит что есть нехватка электронов, следовательно вычитаешь из поряд. Номера 2 эл. И получаешь 24.
а2. Ответ 4. Т. К. Вправо по таблице усиливаются кислотные свойства, следовательно уменьшаются металич.
а3. Ответ 3. Пример h2, n2, o2 и тд
а4. Ответ 1. В 1) +2, 2)+4, 3)+6, 4)+3. Открывай растворимость солей и оснований, там подписаны степень окисления остатков. У некоторый элементы с. О. Постоянная пр. Калий
а5. Я , что тут два ответа 1 и 4, т.к. Метал, свва ослабевают снизу вверх и справо налево
а6. Ответ 1. sp2 говорит о том, что углерод связан двойной связью
а7. Ответ 2. Электроны и протоны равны, нейтроны масса - протон
а8. Ответ 3, т.к. Левее всех
а9. Ответ 3, соотвевует аргону.
а 10. Ответ 1 сразу. Таблица растворимости кислот в помощь.
а 11. Ответ 2, увеличение происходит слева направо
а12. Ответ 3. Это соединение ме-неме
а 13. Ответ 2. те строение алкинов.
в1. А4; б6; в6; г 1
в2. А4; б2; в3; г1
в3. А4; б3; в1; г2
Обоснуйте выделение благородных газов в отдельный класс простых веществ.
Наиболее изученными соединениями благородных газов являются фториды ксенона.
Фторид ксенона (II), или дифторид ксенона. Это соединение может быть получено прямым взаимодействием ксенона и фтора при освещении ртутной дуговой лампой. Его можно также получить взаимодействием ксенона с при температуре — 120 С
Дифторид ксенона состоит из линейных молекул. В присутствии щелочей он гидролизуется с выделением кислорода
Дана перечень элементов C, Na, F, Mg, O, H, S, N, Cl. Исходя из электронного строения атомов, предположите, атомы каких химических элементов могут образовывать химические связи (и какие) при получении:
а) простых веществ (двухатомных молекул)
б) кислот
Двухатомные молекулы могут образовывать атомы, у которых есть по одному или более неспаренному электрону, к ним относятся из предложенных фтор (конфигурация 2s2 2p5), кислород ( 2s2 2p4), водород (1s1), азот (2s2 2p3), хлор (3s2 3p5). Для подробного объяснения лучше конечно нарисовать квантовые ячейки полседнего энергетического уровня
б кислоты могут образовать неметаллы или металлы побочных подгрупп в высшей степени окисления
из предложенных элементов кислоты образуют углерод-угольная кислота H2CO3, фтор-фтороводородная кислота HF, сера серная H2SO4, сероводородная H2S. Сернистая кислоты H2SO3
азотная HNO3, азотистая кислоты HNO3, то есть атомы, у которых на внешнем энергетическом уровне больше 3 электронов и обладающих значительной электроотрицательностью
Какими элементами образованы простые вещества хлор, алюминий, йод, серебро, медь, азот, железо, кремний, свинец. Какие из них являются металлами, а какие – неметаллами?
Хлор, азот, йод, кремний - не металлы, остальное металлы
Хлор(Cl) не металл
алюминий(Al) металл
йод(i) не металл
серебро(Ag) металл
медь(Cu) металл
азот (N) не металл
железо (Fe) металл
кремний (Si) не металл
свинец (Pb) металл
Вычислить Массу водорода(h2) которую можно получить из 32г CH4 при разложении на простые вещества.
Реакция
CH₄ = C+2H₂
Из моля метана - два моля водорода
Молярная масса метана равна 12+4 = 16г/моль, у нас 32 г - значит два моля. Водорода получится 4 моля
Молярная масса водорода 2г/моль, получим мы в итоге 8 граммов водорода
Чем отличается сложное вещество сульфид железа от смеси 2 простых веществ
В первом случае это одно вещество в состав которой входит положительный ион железа и отрицательный ион серы. Вещество группы сульфидов
В природе это вещество может выглядеть как минерал пирротин
Про кристаллическую решетку и ионные связи грузить не буду.
А во втором случае сточите напильником со стула железные ноги до состояния железного порошка и накидайте туда обломанные спичечные головки получите смесь где в одном порошке будет два вещества отдельно Fe (бывшая ножка стула) в состоянии порошка отдельно, S(бывшие спичечные головки)
Возьмите магнит и вы эту смесь разделите. Железо примагнитится, вы его отделите от серы. Простым механическим движением
А теперь возьмите кристалл пиротина. Вы видите только кристалл
Где там железо и сера? Они связаны в ионные связи и мы видим только кристалл а внутри это кристаллическая решетка Их можно разделить только с помощью как сейчас модно говорить "нанотехнологий".
То есть простым механическим способом мы не можем отделить железо от серы.