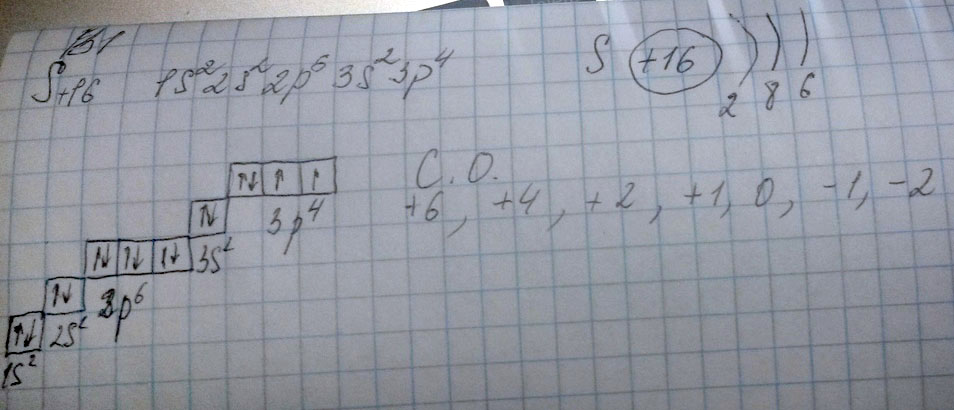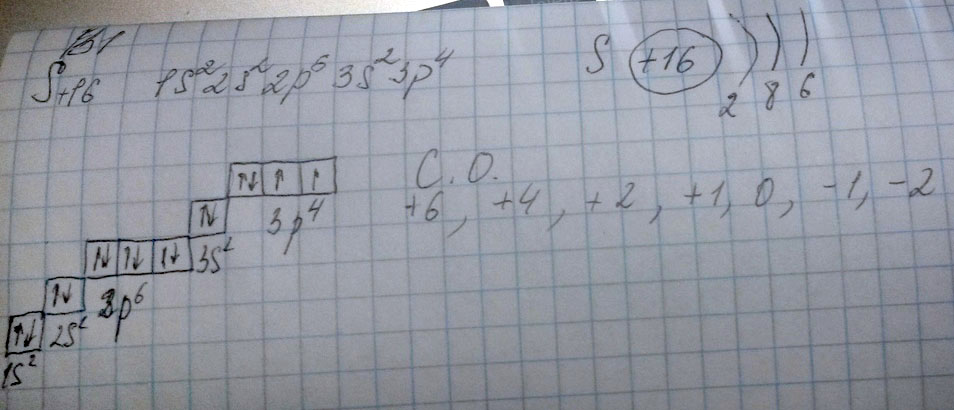Простые вещества - задачи и примеры
1. Определите, к какому классу относится вещество, имеющее формулу ZnO. Назовите его. Напишите уравнения двух химических реакций, наиболее ярко характеризующих его свойства как представителя указанного вами класса.
2. Как изменяется химическая активность простых веществ щелочных металлов от лития к цезию? Почему?
3. Какую массу хрома можно получить из 200 кг оксида хрома (III), содержащего 5 % примесей, алюминотермическим способом? Массовая доля выхода хрома составляет 90 %?
4. Какой объем кислорода(н. у.) портебуется для полного окисления 13 г. Магния?
1. ZnO - это оксид цинка (амфотерный.
Реакция с кислотой:
ZnO + 2HCl = ZnCl2 + H2O
Реакция с щелочью:
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
2. Химическая активность убывает, потому что количество электронов на внешнем электронном уровне возрастает.
3.Дано: m(Cr2O3)=200кг; w(примеси = 5%; wвыхода(Cr)=90%.
Найти: m(Cr)-
Решение: 1) Запишем реакцию: Cr2O3 + 2Al = Al2O3 + 2Cr
2) m(примесей = 200*0.05 = 10г
Найдем массу хрома без примесей:
m(Cr2O3) = 200-10 = 190г
3) n(Cr2O3) = 190/152 = 1.25 моль
4) Соотношение количества оксида хрома к простому веществу хрому 2:1 (оксида хрома больше в 2 раза
n(Cr) = 1.25*2/1 = 2.5 моль
5) m(Cr)=2.5*52 = 130 г
6) Найдем массу с учетом выхода
m(Cr) = 130*0.3 =
39 г4.2Mg +O2 = 2MgO
n(Mg) = m/M = 13/24 = 0.5 моль
n(O2) = 0.5/2 = 0,25 моль
v(O2) =n*22.4 = 0.25*22.4 =
5,6 л Когда говорят что в состав тела человека входит углерод и кальций, то что имеют в виду - элементы или простые вещества? Ответ поясни.
1. Речь идёт об ЭЛЕМЕНТАХ. Атомы углерода и кальция входят в состав молекул различных соединений, из которых состоит тело человека.
2. Как о простом веществе: а, д.
Как о элементе: б, в, г.
3. S⁰ + O₂⁰ = S⁺⁴O₂⁻²
S° - 4e = S⁺⁴
O⁰ +2e = O⁻²
А1. В каком ряду представлены простые вещества-неметаллы:
хлор, никель, серебро 2) алмаз, сера, кальций 3) железо, фосфор, ртуть 4) кислород, озон, азот
А2. Наибольшую степень окисления азот проявляет в соединении:
NH3 2) NO2 3) HNO3 4) HNO3
А3. Электронная формула химического элемента-неметалла
2ē, 1ē 2) 2ē, 8ē, 2ē 3) 2ē, 8ē, 7ē 4) 2ē, 8ē, 1ē
А4. Формула вещества с ковалентной неполярной связью:
NaCl 2) SO2 3) H2 4) Mg
А5. Для простых веществ-неметаллов характерны:
только атомные кристаллические решетки
только молекулярные кристаллические решетки
атомные и молекулярные кристаллические решетки
металлические кристаллические решетки
А6. Элемент-неметалл, не имеющий аллотропных модификаций:
фосфор 2) сера 3) углерод 4) азот
А7. Газ тяжелее воздуха:
водород 2) кислород 3) гелий 4) аммиак
А8. Пара химических элементов, сходных по строению и свойствам:
фтор и хлор 2) магний и алюминий 3) бериллий и бор 4) сера и фосфор
А9. Данное вещество обладает ядовитым действием, не растворяется в воде, в темноте светится:
алмаз 2) угарный газ 3) фосфор белый 4) сера кристаллическая
Часть В. Дайте развернутые ответ, представив подробное решение
В1. Составьте схему строения атома, электронную и электронно-графическую формулу для элемента-неметалла с порядковым номером 14. Спрогнозируйте возможные степени окисления данного элемента.
В2. Расставьте коэффициенты в реакции, используя метод электронного баланса:
Р + КС1О3 = Р2О5 + КС1
В3. Осуществите цепочку превращений:
Сl2 → HCl → ZnCl2 → AgCl
↓
NaCl
При необходимости расставьте коэффициенты в уравнениях реакций и укажите тип реакций.
A1-4
A2-2
A3-3
A4-2
A5-4
A6-3
A7-4
A8-3
A9-2
B1-
B2-6P+5KC₁O₃=3P₂0₅+5KC₁
B3-Cl₂+H₂=2HCl (РЕАКЦИЯ СОЕДИНЕНИЯ)
2HCl+Zn = ZnCl₂+H₂ (РЕАКЦИЯ ОБМЕНА)
ZnCl₂+2AgF = ZnF₂+2AgCl (РЕАКЦИЯ ОБМЕНА)
При образовании сероводорода из простых веществ выделяется теплота в количестве 21кДж. Определите, сколько выделится теплоты при взаимодействии 70,4г серы с избытком водорода
Составим уравнение реакции: S +H2 =H2 Мы видим, что на образования 1 моль сероводорода уходит 1 моль серы. Теперь найдем количество вещества (серы. 70.4/32 =2.2 Теперь перемножим теплоту на количество вещества: 21*2.2 =46.2
1. Наибольшее количество ионов образуется при полной диссоциации 1 моль
1) Фосфата натрия 2) сульфата цинка 3) гидрооксида бария 4) серной кислоты
2. Запрещается ли нагревать герметично закрытую колбу с жидкостью?
3. Среди хим. элементов Cl, S, P
1). Наименьший радиус имеет атомы хлора
2). Наибольшее значение электроотрицательности имеет сера
3). Простые вещества-неметаллы образуют только хлор и сера
4). Низшую степень окисление, равную -3, имеет только фосфор
5). Высший оксид с кислотными св-вами образует только сера
4. Для метанола верны следующие утверждения:
1). Состав молекулы отражает общая формула СпH₂п₊₁OH
2). Атомы углерода и водорода соединены ионной связью
3). Плохо растворим в воде
4). Вступает в реакцию присоединения с водородом
5). Сгорает с образованием углекислого газа и воды
5. Установите соответствие между двумя в-вами и реактивом, с помощью которого можно различить эти два вещества
РЕАГИРУЮЩИЕ В-ВА __РЕАКТИВ
АAl и Mg _____________1. HCl
БK₂SiO₃ и K₂CO₃ ______2. CuO
ВNaCl и Mg(NO₃)₂ ______3. NaOH
4. CuSO₄
6. Установите соответствие между формулой в-ва и реагентами, с которыми это вещество может взаимодейстовать
ФОРМУЛА ВЕЩЕСТВА _______РЕАГЕНТЫ
АCaO ______________________1. Na₂SO₄, AgNO3₃
БH₂SO₄(р-р _________________2. HNO₃, H₂O
ВBaCl₂ ______________________3. Zn, Mg(OH)₂
_____________________________4. NaOH, Ag
7. Даны вещества: AgNO3₃, ZnSO₄, Cu, NaOH, раствор H₂SO₄. Используя воду и необходимые в-ва только из этого списка, получите в 2 стадии гидрооксид меди(II)
1- 1
2- естественно запрещено
3- 1, 4
4- 1, 5
5- а*3, б*1, в*3
а Mg + 2NaOH = Mg(OH)2↓ + 2Na
2Al + 6NaOH (избыток = 3H2↑ + 2Na3AlO3
б K2SiO3 + 2HCl (разб. ) = SiO2↓ + 2KCl + H2O
K2CO3 + 2HCl (разб. ) = 2KCl + CO2↑ + H2O
в NaCl + NaOH = ххх
Mg(NO3)2 + 2NaOH = Mg(OH)2↓ + 2NaNO3
6- а*2, б*3, в*1
а CaO + 2HNO3 = Ca(NO3)2 + H2O
CaO + H2O = Ca(OH)2
б H2SO4 + Zn = H2 + ZnSO4
H2SO4 + Mg(OH)2 = 2H2O + MgSO4
в BaCl2 + Na2SO4 = BaSO4 + 2NaCl
BaCl2 + 2AgNO3 = 2AgCl + Ba(NO3)2
7- Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
Cu(NO3)2 + 2NaOH = Cu(OH)2 + 2NaNO3
А1. В каком ряду представлены простые вещества-неметаллы:
хлор, железо, золото 2) графит, сера, магний 3) цинк, фосфор, серебро 4) бром, озон, кремний
А2. Наименьшую степень окисления фосфор проявляет в соединении:
H3PO4 2) P2O3 3) PH3 4) P2O5
А3. Электронного формула химического элемента-неметалла
2ē, 2ē 2) 2ē, 8ē, 2ē 3) 2ē, 8ē, 6ē 4) 2ē, 8ē, 3ē
А4. Формула вещества с ковалентной полярной связью:
КBr 2) NH3 3) O2 4) Fe
А5. Для простых веществ-неметаллов характерны:
металлические кристаллические решетки
только атомные кристаллические решетки
только молекулярные кристаллические решетки
атомные и молекулярные кристаллические решетки
А6. Элемент-неметалл, не имеющий аллотропных модификаций:
фосфор 2) кремний 3) углерод 4) азот
А7. Газ легче воздуха:
угарный газ 2) аммиак 3) сернистый газ 4) озон
А8. Пара химических элементов, сходных по строению и свойствам:
бром и сера 2) магний и натрий 3) азот и фосфор 4) кремний и кислород
А9. Данное вещество обладает резким запахом, хорошо растворяется в воде, вызывает посинение влажной лакмусовой бумаги:
сероводород 2) углекислый газ 3) метан 4) аммиак
Часть В. Дайте развернутые ответ, представив подробное решение
В1. Составьте схему строения атома, электронную и электронно-графическую формулу для элемента-неметалла с порядковым номером 16. Спрогнозируйте возможные степени окисления данного элемента.
В2. Расставьте коэффициенты в реакции, используя метод электронного баланса:
Р + HNO3 (конц. ) = Н3РО4 + NO2 + Н2О
В3. Осуществите цепочку превращений:
Si → SiO2 → Na2SiO3 → H2SiO3 → SiO2
При необходимости расставьте коэффициенты в уравнениях реакций и укажите тип реакций.
В4.
80 грамм технического цинка, содержащего 20 % примесей, прореагировало с серной кислотой. Найдите объем выделившегося газа (при н.у. ).
A1. 4
A2. 3
A3. 3
A4. 2
A5. 1
A6.4
A7. 3
A8. 3
A9. 4
B2. P + 5HNO3 = H3PO4 + 5NO2 + H2O
P(0) - 5e = P(+5) восстановитель окисление
N(+5) + 1e = N(+4) окислитель восстановление
B3. Si+О2 = SiО2.
SiО2+2NаОН = Nа2SiО3+Н2О.
Nа2SiО3+2НСl = Н2SiО3+2NаСl.
Н2SiО3 = SiО2+Н2О
B4. Zn+H2SO4 = ZnSO4+H2
0.24 0.24 0.24
80*0.2 = 16
n(Zn)=16/65 = 0.24 моль
V(H2)=0,24*22,4 = 5,376 л
m(ZnSO4)=0,24*161 = 38,64 г