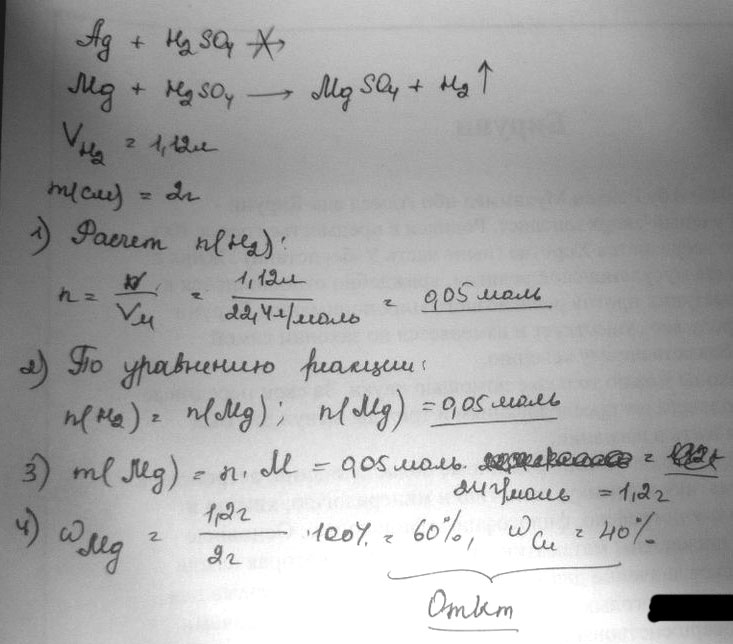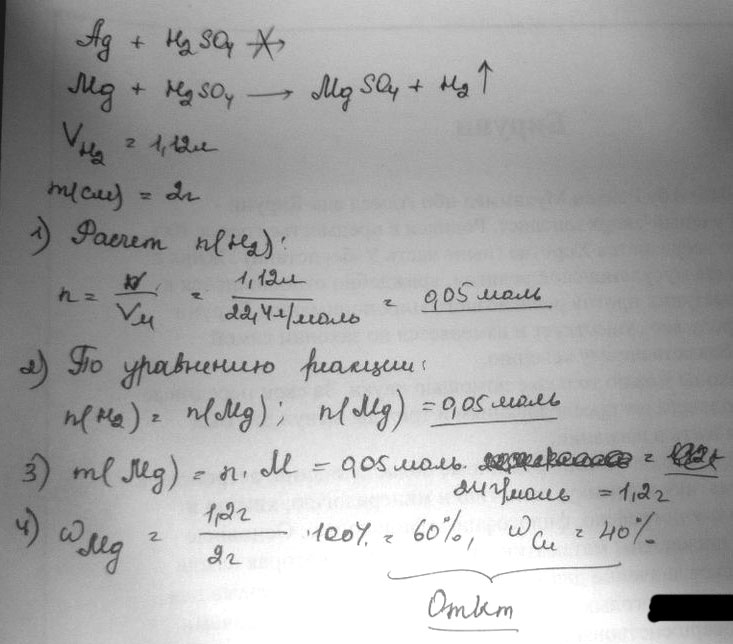Свойства смесей - задачи и примеры
Смесь состоит из 100 молекул гелия и 200 молекул кислорода. Какое число атомов содержится в смеси
Т. К. Гелий имеет одноатомную молекулу (He), то число молекул гелия равно числу его атомов. ⇒ 100 атомов
Т. К. Кислород имеет двухатомную молекулу (O₂), то число атомов в два раза больше числа молекул ⇒ 400 атомов
Количество атомов в смеси = 500
В смеси 500молекул так кае 200молекул кислорода 1молекула кислорода примерно 2молекулы атома 200×2 = 400+100молекул гелия
ответ 500
20 г смеси меди и магния обработали соляной кислотой. При этом выделилось 13,067 л водорода. Вычислите процентное содержание металлов в исходной смеси.

Смесь поваренной соли и песка массой 8г поместили в 40г воды. Песок не растворился, а соль растворилась, и оброзовался раствор объемом 44,0 мл и плотностью 1,05 г/мл.
?1) определите массы соли и песка в смеси.
?2) определите массовую долю соли в получении растворе.
?3) предложите способы выделения песка из смесей, провиденных ниже
А песок с деревянными и железными опилками.
Б песок с содой и порошком мела
1. Рассчитаем массу полученного раствора:
m(р-ра = ρV = 44,0 мл * 1,05 г/мл = 42 г
2. Обозначим массу соли за x грамм, тогда масса песка: (8-x) г
Масса раствора будет складываться их массы воды и соли, за вычетом массы осевшего песка:
m(р-ра = m(соли + m(воды - m(песка - x + 40 - (8-x) = 2x + 32
Составим и решим уравнение:
2x + 32 = 42
2x = 10
x = 5
масса соли - 5г
масса песка 8-5 = 3 г
Массовая доля соли:
w = [m(соли]/[m(р-ра] *100% = 5г/42г * 100% = 11,9%
А Провести над смесью магнитом - избавимся от железных опилок, т. к. Железо единственное из смеси обладает магнитными свойствами, затем растворим все в воде, песок осядет, деревянные опилки останутся на поверхности. Стружки деревянные сливаем, песок фильтруем
Б Все в воду - сода растворится, порошок мела останется на поверхности, песок осядет на дно. Сливаем порошок мела, песок фильтруем В пробирки содержащую раствор карбоната и сульфата натрия, прилипли сначала раствор хлорида бария, а после окончания реакции добавили избыток соляной кислоты. Что происходило в пробирке? Каков состав конечной смеси?
Na₂CO₃ + BaCl₂ ≠
Na₂SO₄ + BaCl₂ = 2NaCl + BaSO₄(в осадок
Потом добавили избыток соляной кислоты
Na₂CO₃ + 2HCl = 2NaCl + CO₂(выделяется газ + H₂O
BaSO₄ + 2HCl ≠
Состав конечной смеси: NaCl,BaSO₄
Смесь поваренной соли и песка массой 8 г поместили в 40 г воды. Песок не растворился, а соль растворилась, и образовался раствор объемом 44,0 мл и плотностью 1.05 г/мл а определите массы соли и песка в смеси б определите массовую долю соли в полученном растворе в предложите способы ввделения песка из смесей, приведенных ниже 1) песок с деревянными опилками и желещными опилками 2) песок с содой и порогком мела
1. Зная объем и плотность конечного раствора - найдем массу раствора:
m = ρV = 44,0мл*1,05 г/мл = 42 г
2. Обозначим за x - массу соли (г), тогда, масса песка будет (8-x) (г)
3. Масса конечного раствора складывается из трех компонентов - суммы масс соли и воды, за вычетом массы песка:
m(р-ра = m(соли + m(H₂O) - m(песка = x + 40 г - (8-x) = 2x + 32
Мы рассчитали массу раствора, т. к. Знаем плотность и объем, составляем и решаем уравнение:
2x + 32 = 42
2x = 10
x = 5 г - масса соли
Масса песка 8-5 = 3 г
Массовая доля соли в полученном растворе:
w(соли = [m(соли]/[m(р-ра]*100% = 5г/42г * 100% = 11,9%
Ответ:.
Песок с деревянными и железными опилками:
1. Провести магнитом - удалятся железные опилки, так как железо обладает магнитными свойствами. Затем растворить смесь воде - песок опустится на дно, а деревянная стружка останется на поверхности.
2. Растворить в воде - песок осядет на дно, сода растворится, а порошок мела останется на поверхности.
2 грамма смеси серебра и магния обработали розбавленою серной кислотой. Объём водорода, что отделится становится 1,12 литров найти массовые части металлов в смеси
В прикрепленном файле, спрашивай чего не поймешь