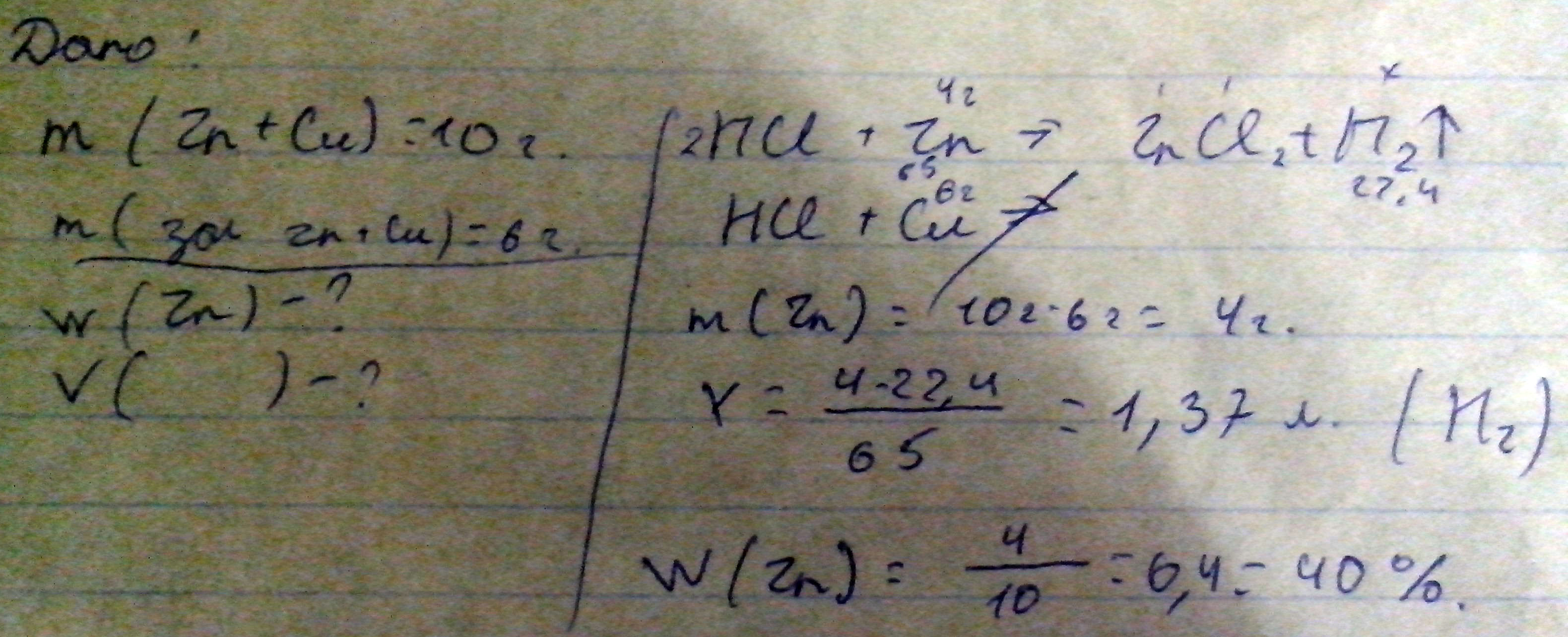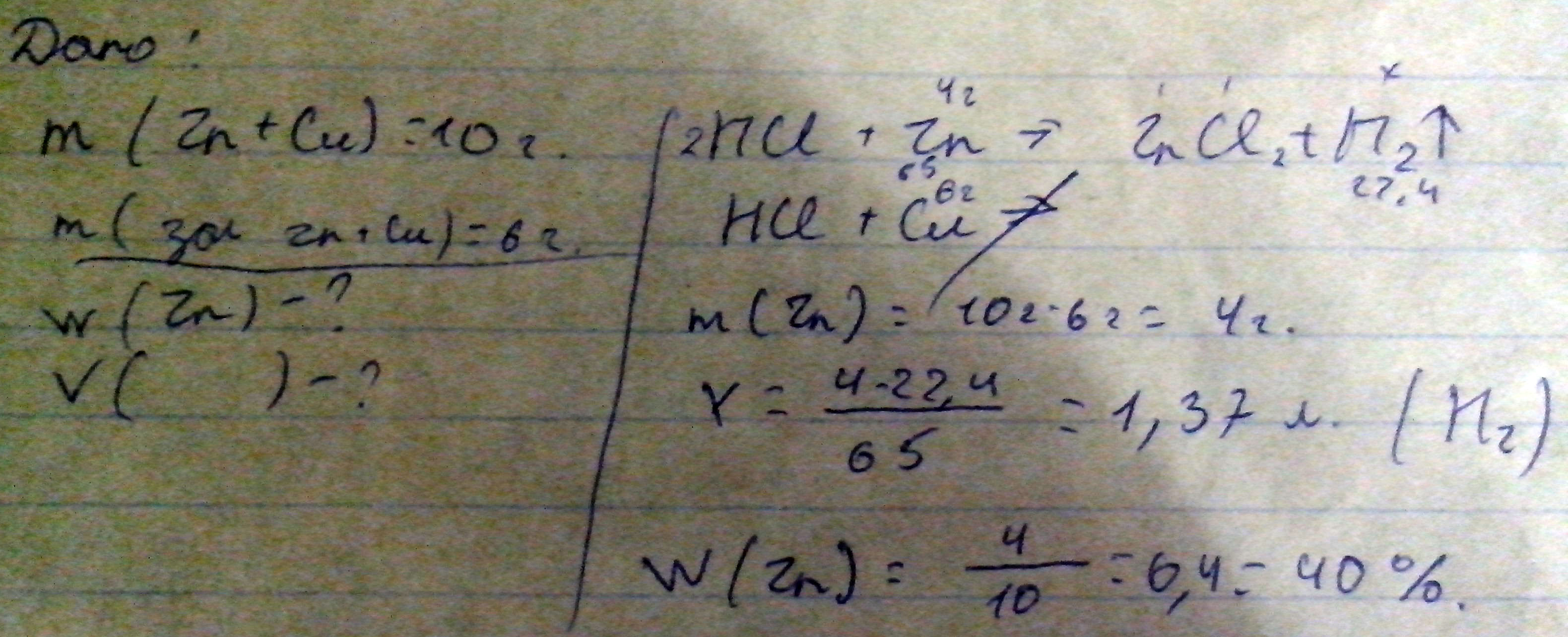Свойства смесей - задачи и примеры
Смесь цинка и его нитрата прокалили на воздухе, при этом ее масса не изменилась. Определите массовую долю цинка в смеси
Очевидно, что Zn, сод-ся в смеси, поглотил из воздуха массу O2, равную суммарной массе газообр-х продуктов разложения Zn(NO3)2 по р-м: а Zn (М = 65 г/моль + 0.5O2 = ZnO и б Zn(NO3)2 (M = 189 г/моль = ZnO + 2NO2 (M = 46 г/моль + 0.5O2 (М = 32 г/моль;
1) Из 92 г этанола получили 42 л этена. Найдите выход реакции(%). 2) Какой объем этена можно получить из 500 мл( вместительность 0.8г/мл 96% концентрации раствора этанола, если выход реакции равен 80%?
3) 0,8 л смеси этана и этена пропустили через 200 г 1,6% концентрации бромовой воды. Посчитайте состав смеси этана и этена
(перевод с литовского
Прикрепил 3 фотографии
актуально

В закрытом сосуде взорвали 60 мл смеси водорода и хлора. Поле приведения газов к первоначальным условиям оказалось, что12 мл хлора осталось в избытке. Определите объемный состав газовой смеси до и после реакции. Изменился ли общий объем газов в ходе реакции? Ответ обоснуйте.
Уравнение реакции:
H₂ + Cl₂ = 2HCl
По уравнению реакции видим, что количества вещества хлора и водорода равны, а значит их объемы так же равны.
Обозначим за x мл - V(H₂)
Тогда V(Cl₂) = (x + 12) мл
Из условия суммарный объем газов 60 мл, составим уравнение:
x + (x + 12) = 60
2x + 12 = 60
2x = 48
x = 24
Объем водорода 24 мл
Объем хлора 24 + 12 = 36 мл
Объемные доли до реакции соответственно:
φ(H₂) = 24 мл/60мл *100% = 40%
φ(Cl₂) = 60%
После реакции в системе будут хлороводород и избыточный хлор - 12 мл
Объем хлороводорода по уравнению реакции:
V(HCl) = 2V(H₂) = 48 мл
Находи доли газов после реакции:
φ(Cl₂) = 12мл/60мл *100% = 20%
φ(HCl) = 48мл/60мл *100% = 80%
Объем смеси не изменится, так как сосуд закрытый
актуально
Что такое что такое неоднородная смесь
Однородная смесь - это смесь, где вещества находятся в одной фазе, их называют еще гомогенными. Пример - раствор серной кислоты - это смесь воды и кислоты, и они все в жидеом состоянии
Неоднородная смесь - это смесь, где вещества находятся в разных фазах. Например твердое и жидкое или газообразное и жидкое. Пример - песок в воде. Другое название - гетеровенные системы. При этом часто из-за разности плотности смеси имеют границу раздела фаз - песок оседает на дно и мы видим границу. А в однородной смеси границы нет
Последовательность действий при разделении смеси соли и древесных опилок следующая:
Смесь бросить в воду, опилки всплывут, а соль растворится, отделить опилки от раствора с помощью марли например. Оставшийся раствор поставить в тёплое сухое место, вода испарится - останется соль. Вуаля.
Смесь медных и цинковых опилок массой 10г. Поместили в раствор соляной кислоты и нагрели до прекращения выделения газа. Масса оставшихся опилок составила 6 г. Найдите массовую долю цинковыХ опилок в исходной смеси и объем выделиашегося газа
Реакція сол. Кислоти з мідю не проход. Отже масса опілок, що залиш. =4 г. = цинк.