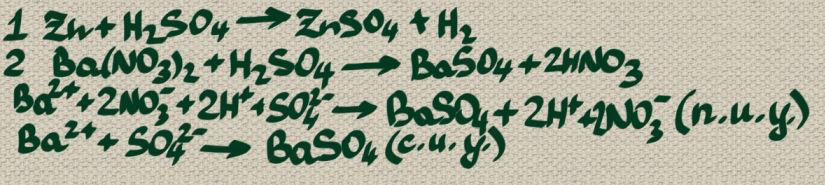Запишите уравнения реакций в молекулярном - задачи и примеры
2. Каким набором реактивов можно определить качественный состав серной кислоты:
аZn и K2CO3
бCu и BaCl2
вZn и Ba(NO3)2
Напишите уравнения реакций в молекулярном и ионном виде.
В цинк и нитрат бария
Цинк будет вытеснять водород из молекул серной кислоты (что будет сопровождаться выделением газа, а в реакции обмена с солью выпадет специфичный мелкодисперсный осадок BaSO4.
Примечание: п. И. У. Полное ионное уравнение, с. И. У. Сокращенное ионное уравнение.
Закончите уравнения возможных реакций в молекулярном виде:
1) SO2+H2O =
Na2O+H2o =
N2O5+H2O =
SiO2+H2O =
FeO+H2O =
Al2O3+H2O =
CaO+H2O =
CuO+HNO3 =
MgO+KOH =
N2O5+KOH =
SO2+Cu(OH)2 =
SO2 + H2O -> H2SO3
Na2O + H2O -> 2NaOH
N2O5 + H2O -> 2HNO3
SiO2 + H2O. Реакция не идет
FeO + H2O реакция не идёт
Al2O3 + 3H2O -> 2Al(OH)3
CaO + H2O -> Ca(OH)2
CuO + 2HNO3 -> Cu(NO3)2 + H2O
MgO + KOH. Реакция не идет
N2O5 +2 KOH -> 2KNO3 + H2O
SO2 + Cu(OH)2 реакция не идет
Напишите уравнения реакций в молекулярном, полном и сокращенном ионном виде между следующими веществами: а) сульфидом железа (II) и соляной кислотой;
б) гидроксидом бария и серной кислотой
А
В молекулярном виде:
FeS+2HCl = FeCl₂+H₂S↑
В полном ионном виде:
FeS+2H⁺+2Cl⁻ = Fe²⁺+2Cl⁻+H₂S↑
В сокращенном ионном виде:
FeS+2H⁺ = Fe²⁺+H₂S↑
б
В молекулярном виде:
Ba(OH)₂+H₂SO₄=BaSO₄↓+2H₂O
В ионном виде:
Ba²⁺+2OH⁻+2H⁺+SO₄²⁻ = BaSO₄↓+2H₂O
Уравнения не сокращается
Как отличить растворы иодида натрия и сульфата натрия? Предложите два способа и напишите уравнения реакций в молекулярном и ионном видах.
1 способ
1) Если добавить в раствор иодида натрия нитрат серебра, образуется жёлтый осадок иодид серебра:
AgNO3 + NaI = AgI + NaNO3
Ag+ + I- = AgI
2) Если добавить в раствор сульфата натрия хлорид бария, выпадет белый осадок сульфат бария:
BaCl2 + Na2SO4 = BaSO4 + 2NaCl
Ba(2+) + SO4(2-) = BaSO4
2 способ
При добавлении к иодиду натрия смеси перманганата калия и гидроксида калия выделится газ фиолетового цвета - атомарный йод:
2NaI + 2KMnO4 + 2KOH = I2 + 2K2MnO4 + 2NaOH
Вам даны три пробирки с растворами. Определите, в какой из них находится соляная кислота, серная кислота и гидроксид натрия. Напишите уравнения соответствующих реакций в молекулярном и ионном виде
1) Если добавить в пробирку с гидроксидом натрия сульфат меди образуется голубой осадок: CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4;
Cu²⁺ + 2OH⁻ → Cu(OH)2↓
2) Если добавить в раствор соляной кислоты хлорид бария то образуется белый студенистый осадок, нерастворимый в сильных кислотах - сульфат бария:
BaCl2 + H2SO4 → BaSO4↓ + 2HCl; Ba²⁺ + SO4²⁻ → BaSO4↓
3) Если добавить в раствор соляной кислоты нитрат серебра то вырадет белый творожистый осадок - хлорид серебра:
AgNO3 + HCl → AgCl↓ + HNO3
Ag⁺ + Cl⁻ → AgCl↓
С какими из ниже перечисленных веществ будет реагировать раствор H2SO4:
Cu, Ca(OH)2, ZnO, Fe, BaCl2, Al(OH)3
Напишите уравнения осуществимых реакций в молекулярном, а где необходимо - Ионном виде.
1) H2SO4+Ca(OH)2 = CaSO4+2H2O
Ионное уравнение:
2H(+)+SO4(-2)+Ca(+2)+2OH(-)=
=Ca(+2)+SO4(-2)+2H2O
в сокращенном виде:
2H(+)+2OH(-)=2H2O
2) ZnO+H2SO4 = ZnSO4+H2O
3) Fe+H2SO4 = FeSO4+H2
4)3H2SO4+2Al(OH)3 = Al2(SO4)3+6H2O
Ионное уравнение:
6H(+)+2SO4(-2)+2Al(OH)3 =
=2Al(+3)+3SO4(-2)+6H2O
в сокращенном виде:
6H(+)+2Al(OH)3 = 2Al(+3)+6H2O