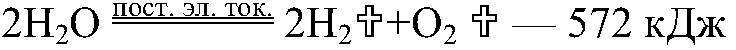Термохимические уравнения - задачи и примеры
Какое количество теплоты выделится при сгорании 1000 л бытового газа(условно- чистый метан при нормальных соответствии с термохимическим уравнениям реакции CH4 + 2O2 = CO2 + 2H2O + 878 кДж. Сделатье, Я кто сделает
714,24г хкДж
CH4 + 2O2 = CO2 + 2H2O + 878 кДж.
16г
n(CH4)=V/Vm = 1000л/22.4л/моль=44.64моль m(CH4)=n*M = 44.64*16 = 714.24г
хкДж = 714,24*878/16 = 39194 кДж
1000л хкДж
CH4 + 2O2 = CO2 + 2H2O + 878кДЖ
n = V : Vm
n(CH4)= 1000л: 22,4 л/моль = 44,6 моль
1 моль (CH4) - 878 кДж
44,6 моль - х кДж
х= 878 * 44,6 = 39196,4 кДж
Какое количество теплоты выделится при сгорании 1000 л бытового газа(условно- чистый метан при нормальных соответствии с термохимическим уравнениям реакции CH4 + 2O2 = CO2 + 2H2O + 878 кДж
По условию задачи при сгорании одного моль метана выделяется 878 кДж теплоты.
При норм. условиях 1 моль любого газа занимает объем 22,4 л.
Соответственно, х моль любого газа занимает объем 1000 л
х = 1000 л / 22,4 л = 44,6.
Соответственно, теплота сгорания 1000 литров газа равна 44,6*878 кДж =
= 39200 кДж ≈ 39 МДж
Составте термохимическую уравнение реакцыи горения метана в кислороде если при сжыгании 21 л метана (н.у.) выделилось 837 кДж теплоты
Реакция горения метана описывается уравнением:
CH4 + 2O2 = CO2 + 2H2O
нужно найти, сколько выделится теплоты при сжигании 1 моль метана.
Найдем, сколько у нас метана в молях:
n = V/Vm = 21/22.4 = 0.9375 моль
т.е. При сжигании 0,9375 моль метана выделяется 837 кДж теплоты. Составим пропорцию:
0,9375 моль - 837 кДж
1 моль - х кДж
х = 837/0,9375 = 892,8 кДж
Термохимическое уравнение принимает вид:
CH4 + 2O2 = CO2 + 2H2O + 892,8 кДж
Чем отличается химические уравнения от термохимических уравнений? Поясните на конкретных примерах. НУЖНО
В термохимических уравнениях есть температура (теплота, а в химических его нет
Уравнения химических реакций, в которых приводятся значения тепловых эффектов (или обозначаются знаком Q) называются термохимическими.
В этом случае между левой и правой частями ставится знак равенства, т. к. Теплота, выделяемая или поглощаемая в результате химического превращения, является своеобразным «реагентом» или «продуктом» химической реакции.
Например:2H2+O2 = 2H2O+572кДж
(«продукт» химической реакции
(«реагент» химической реакции
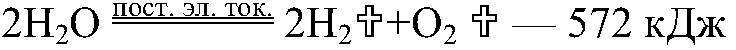
Выбрать три окислительно-восстановительные реакции и составить уравнения электронного баланса. 2. На основании термохимического уравнения решить задачу:
Реакция протекает по уравнению 2Mg+CO2 = 2MgO+C+810кДж. рассчитайте какое кол-во теплоты выделится при окислении 120 г магния
Что значит первая часть Вашего запроса?
n(Mg) = 120 г: 24 г/моль = 5 моль
На каждые 2 моль магния приходится 810 кДж, значит
Q = 2.5 моль * 810 кДж = 2025 кДж
V(Mg)=5моль
по пропорции
52 = x810
x = 5*1802 = 2025 кДж
Ответ: 2025кДж
Объясните термохимические уравнения, желательно с примером
[ в приложенном файле ] тут тупо пропорция. Но если относительно данного в-ва ( теплоту которого надо найти сколько там поглощено стоят еще стехиометрические коэффициенты, то не забывать молярку множить на эту цифру в уравнении. Там еще может вопрос стоять так: При образовании аммиака согласно уравнению: N2(г). )+3H2(г). )=2NH3(г). ) +92кДж, выделилось 23 кДж теплоты. При этом V вступившего в реакцию водорода составил: все тоже самое, тупо пропорция. Множим теплоту данную по условию т.е. 23кДж на объем этого водорода и умножаем на 3 согласно коэффициенту: [22,4×3×23кДж] и делим на теплоту выделившеюся в процессе реакции т.е. На 92 кДж = 16,8 л. Может еще условие так стоять: в каком количестве выделится теплота? Например: 2Cl2O7 = 2Cl2+7O2+570 кДж при разложении 36,6 г оксида хлора Vll выделится теплота в количестве: тоже пропорция ничего нового. Множим массу относительно выделившейся теплоты и делим на молярку согласно коэффициентам: [36,6г×570кДж]÷183г/моль×2(коэффициент=57кДж.

Термохимическая задача
C2H4+3O2 = 2CO2+2H2O+1400 кдж. Найдите объём C2H4, если Q = 70кдж
хл 70кдж
C2H4+3O2 = 2CO2+2H2O+1400 кдж.
22,4 л
хл-70кдж
22,4л-1400
х=22,4*70/1400 = 1,12 л
ответ 1,12л.
V л 70 кДж
C2H4+3O2 = 2CO2+2H2O+1400 кдж.
22.4 л
V/22.4 = 70/1400
V = 22.4*70/1400 = 1.12 л
Уравнение будет термохимическим если оно ....
Химические уравнения в которых указывает тепловой эффект, называется термохимически уравнения
С начало смотришь на задачу составляешь дано решаешь уравнения и потом састовляешь термохимически уравнения

Написать по 2 примера: на все виды реакции по химии
1 ) ОВР
2 ) Обмен
3 ) Термохимический вид
4 ) Реакция по направлению
1) ОВР – должны меняться степени окисления в ходе реакции
2Na + Cl₂ = 2NaCl
MnO₂ + 4HCl = MnCl₂ + Cl₂ + 2H₂O
2) Обмен
2NaOH + H₂SO₄ = Na₂SO₄ + 2H₂O
BaCl₂ + K₂SO₄ = BaSO₄↓ + 2KCl
3) Термохимическое – обычно реакции горения
CH₄ + 2O₂ = CO₂ + 2H₂O + Q
2C₂H₂ + 5O₂ = 4CO₂ + 2H₂O + Q
4) По направлению – подразделяют на обратимые и необратимые (обратные и прямые, соответственно
3H₂ + N₂ ⇔ 2NH₃ – пример обратимой
AgNO₃ + KCl = AgCl↓ + KNO₃ – пример необратимой (осадок AgCl обратно ну никак не растворишь
По термохимическим уравнением H2 (г). ) + Cl2 (г). ) = HCl (г). ) ΔH = -184 кДж
вычислите количество (кДж тепловой энергии, которая выделится, если прореагировал водород объемом 560 мл (н.у.).
Уравнение стоит записать немного точнее H2 (г). ) + Cl2 (г). ) = 2HCl (г). ) ΔH = -184 кДж Считаем количество водорода (560 мл = 0,56 л 0,56/22,4 = 0,025 моль. Из уравнения видим, что при горении 1 моль водорода выделяется 184 кДж, а при горении 0,025 моль выделяется х кДж. Х = 184*0,025/1 = 4,6 кДж. Ответ: 4,6 кДж.