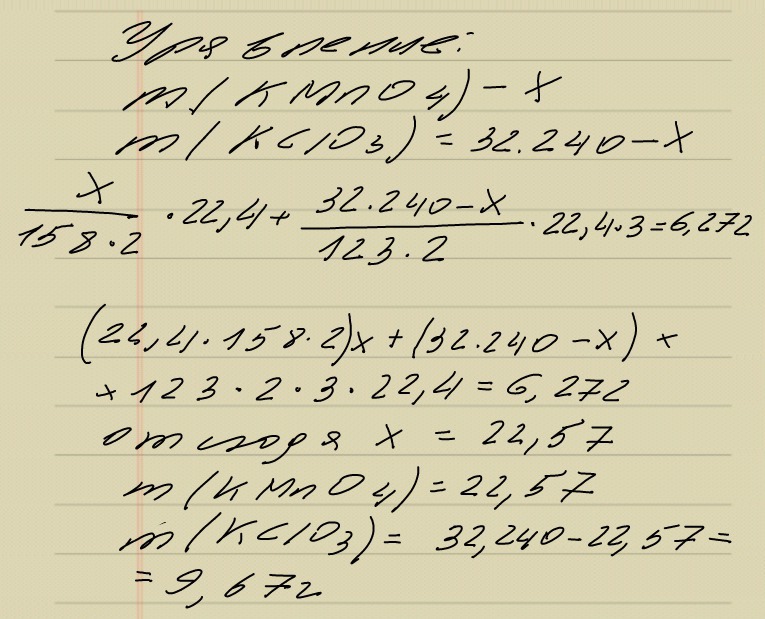Реакции разложения - задачи и примеры
1) вычислите объём углекислого газа н.у., который выделится в результате взаимодействия 300г карбоната калия содержащего 5% примесей с соляной кислотой
2) вычислите объём углекислого газа, который выделится в результате разложения карбоната калия содержащего 20% примесей
Записываем уравнение К2СО3+2НСL2 = 2KCL+2HO+CO2 1мольК2СО3 = 138 граммов 1 моль СО2 занимает объём 22,4 литра Находим чистого карбоната калия 100%-5%=95% ОТ 300г это будет285граммов Составляем пропорцию из 138 граммовкарбоната калия получается 22,4 литра углекислого газа а из 285граммов получается х литров находим Х нужно 285*22,4:138 = 46,3литра
Составьте уравнения реакции разложения следующих оксидов: а) Hg2O б) CuO в) Al2O3
Оксид ртути разкладывается при нагревании на ртуть и оксиген, а оксид алюминия можно разложить при действии на него серной кислотой и оксид меди точно так же как, и оксид алюминия
1 - приведите примеры применения углекислого газа
2 - определите относительную плотность:
а углекислого газа по водороду
б угарного газа по амонуаком
3 - приведите примеры молекулярных уровень двух химических реакций, которые можно выразить одним сокращенным ионным уравнением: NH4 (+) + ОH (-) → NH3 ↑ + H2О
4 - составьте уравнения реакций термического разложения следующих солей аммония:
а аммоний карбоната
б аммония нитрата
1. Углекислый газ в силу своих свойств не поддерживать горение используется в пожаротушении, в силу того, что водный раствор его-это раствор угольной кислоты применяется для производства газированных напитков, при выходе сжатого углекислого газа из баллона (чёрного цветасильно понижает температуру, применяется в сталелитейном деле, используется для получения сухого льда, в медицине в спец. Приборах для людей стращих высоким давлением и т. д. Но самое главное-это участие углекислого газа в процессе фотосинтеза, благодаря которому в зеленых пластинах листьев-хлорофилле на свету, в присутствии воды образуется кислород и углеводы. Круговорот углекислого газа в природе, один из факторов обеспечения жизни на Земле.
2. Плотность углекислого газа по водороду равна 22, т. к. Молярная масса углекислого газа 44г/моль делим на молярную массу водорода
Д (CO)2 по водороду = 44:2 = 22
по аммиаку 44:17 = 2,59 (молярна масса аммиака равна 17 гмоль
3. 2NH4Cl+ Ca(OH)2= 2NH3+ CaCl2+2H2O
РАЗЛОЖЕНИЕ
2NH4CO3 = 2 NH3+2 CO2+H2O
NH4NO3 = N20 +2H2O
В ходе каталитического разложения 50 мл раствора пероксида водорода образовалось 5,6 л газа при норм. Усл. Рассчитайте массовую концентрацию перекиси водорода.
х г 5,6 л
2H2O2 = 2H2O + O2
68 г 22,4 л
х= 17 г
Примем плотность р-ра пероксида водорода за 1 г/мл, тогда масса р-ра Н2О2 = 50 г
ω(Н2О2) = 17 г/50 г*100% = 34%
Ответ: 34%
2H2O2 = 2H2O+O2
n(O2)=5,6/22,4 = 0,25моль
n(H2O2)=2n(O2)=0,25×2 = 0,5моль
V(H2O2)=0,5×22,4 = 11,2л
m(H2O2)=0,5×34 = 17г
W(H202)=17/50×100%=34%
В результате полного разложения смеси калий перманганата и калий хлората массой 32,240г выделился газ объемом 6,272дм от которого загорелась лучина. Определите состав исходной смеси по массе.
2KMnO4[t]=K2MnO4+MnO2+O2; 2KClO3(MnO2,t)=2KCl+3O2; M(KMnO4)=158г/моль; M(KClO3)=123г/моль; m(KMnO4)=x г; M(KClO3)=32.240г-х; [х÷158г/моль×2]×22,4+[32.240-х÷123г/моль×2]×22,4×3 = 6,272; х=22,57 KMnO4 и 32,240-22,57= 9,67 г KClO3.[ в приложенном файле ]
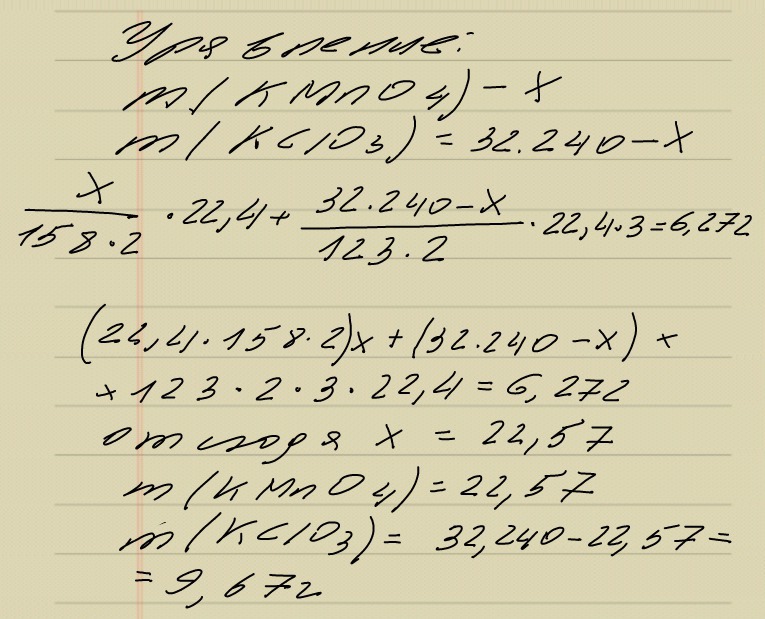
Записать по три уравнения реакций обмена и разложения.
CaCl2 + Na2CO3 = CaCO3¯ + 2NaCl - реакция обмена;
2NaBr + Cl2 = 2NaCl + Br2 - реакция замещения;
РЕАКЦИИ ОБМЕНА
1) MgO+2HBr = MgBr2+H2O
2) Al(NO3)3+3NaOH = Al(OH)3+3NaNO3
3)3H2SO4+2Fe(OH)3 = Fe2(SO4)3+6H2O
РЕАКЦИИ РАЗЛОЖЕНИЯ
1)2H2O = 2H2+O2
2)2Al(OH)3 = Al2O3+3H2O
3)2Ag2O = 4AgO2
Составьте уравнение разложения на ионы для данных веществ. Для многоосновной кислоты составьте уравнение полной и ступенчатой диссоциации
a) HNO₃ -> гH₂SO₄ -> (полная
бK₃PO₄-> (1 ступень
вBa(OH)₂ (2 ступень
Халявщики лесом
а HNO₃ → H⁺ + NO₃⁻
б K₃PO₄ → K⁺ + K₂PO₄⁻ (1 ступень
K₂PO₄⁻ → K⁺ + KPO₄²⁻
KPO₄²⁻ → K⁺ + PO₄³⁻
в Ba(OH)₂ → Ba(OH)⁺ + OH⁻
Ba(OH)⁺ → Ba²⁺ + OH⁻ (2 ступень
г H₂SO₄ → H⁺ + HSO₄⁻
HSO₄⁻ → H⁺ + SO₄²⁻
В лаборатории перемешались порошки нитратов калия и натрия. Чтобы определить состав образовавшейся смеси, лаборант прокалил образец массой 2,285 г до прекращения выделения газов. При этом он получил 280 мл бесцветного газа. Определите состав смеси и напишите уравнения реакций разложения.

1) напишите названия реакций, каждому веществу из цепочки дайте название. Fe-> Fe2O3-> Fe2(SO4)3-> Fe(OH)3-> H2O
2) В реакцию разложения вступило 50 грамм карбоната кальция. Какой газ и сколько его массе и по количеству образовалось?
3) разберите сущность окислительно - восстановительной реакции K+H2O-> KOH+H2
4) Укажите тип химической связи в следующих веществах:
Cl2, SiO2, BaF2, Al
1) 4Fe + 3O2 = 2Fe2O3 (соединение ( железо, кислород, оксид железа
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O ( обмен ( оксид железа, серная кислота, сульфат железа, вода
Fe2(SO4)3 + 6NaOH = 2Fe(OH)3 +3 Na2SO4 (обмен ( сульфат железа, гидроксид натрия, гидроксид железа, сульфат натрия
2Fe(OH)3 -> Fe2O3 +3H2O ( разложение ( гидроксид железа, оксид железа, вода
2) 50 г Х г, Х моль
СаСО3 -> СаО + СО2 (углекислый
n = 1 моль n = 1 моль
Mr = 100 г/моль Mr = 44 г/моль
m = 100 г m = 44 г
50 г СаСО3 - Х г СО2
100 г СаСО3 - 44 г СО2
m(CO2) = 50 * 44 / 100 = 22 г
50 г СаСО3 - Х моль СО2
100 г СаСО3 - 1 моль СО2
n(CO2) = 50 / 100 = 0,5 моль
3) 2K + 2H2O = 2KOH + H2
K(0) -1e = K(+) 2 в-ль, ок-ие
2H(+) +2e = H2(0) 1 ок-ль, в-ие
4) Cl2 - ковалентная неполярная
SiO2 - ковалентная полярная
BaF2 - ионная
Al - металлическая
Приведите по два примера реакций соединения и разложения, которые не являются окислительно-восстановительными.
CaCO3 = CaO + CO2(данную реакцию, в пример не приводить.
$$ Cu(OH)_2 = t=CuO+H_2O H_2SiO_3 = t = H_2O+SiO_2 \\ Na_2O+H_2O = 2NaOH N_2O_5+2H_2O = 2HNO_3 $$