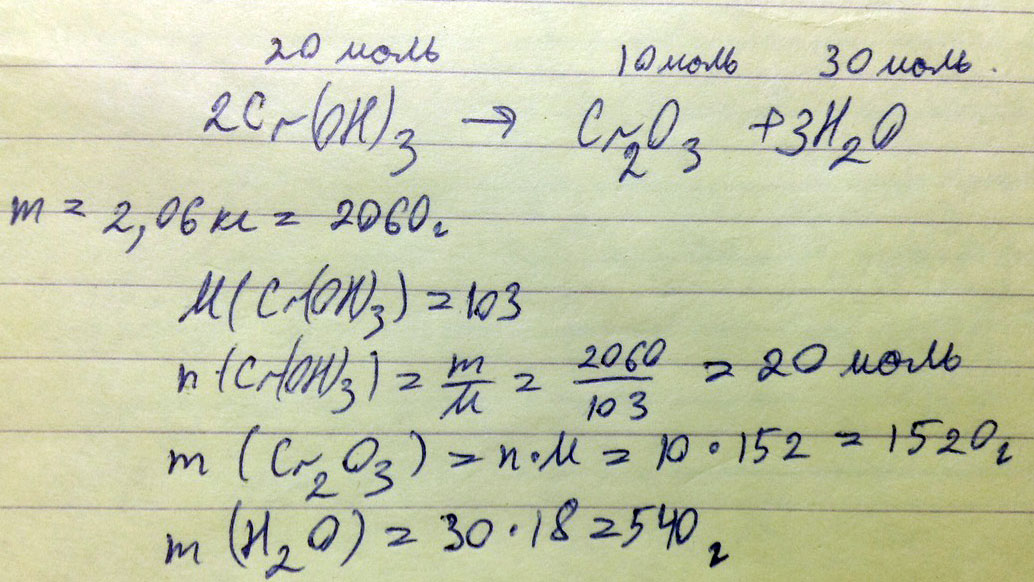Реакции разложения - задачи и примеры
Вычислить объем СО2 который выделился при разложения 100г мела при нагревании
100г х л
CaCO3 = CaO+CO2 х=100*22,4/100 = 22,4 л
100 22,4
Дано:
m(СаСО3)=100г
Найти:
V(СО2)=?
Решение:
m = 100г V=?
СаСО3 = СаО+СО2
m = 100г V = 22,4 лмоль
m = M*n
М(СаСО3)=40+12+16*3 = 100гмоль
m = 100гмоль*1моль=100г
V = Vm*n
Vm = 22,4 лмоль
V = 22,4 лмоль*1 моль=22,4 л
100 = х
100 22,4
Решаем пропорцией
х=100*22,4100 = 22,4
Ответ: V(СО2)=22,4 л
В результате реакции разложения гидроксида хрома(III) образуется оксид хрома(III) и вода. Определите массы продуктов реакции, полученных при разложении 2,06 кг гидроксида хрома(III)
Граммы - это система СИ.
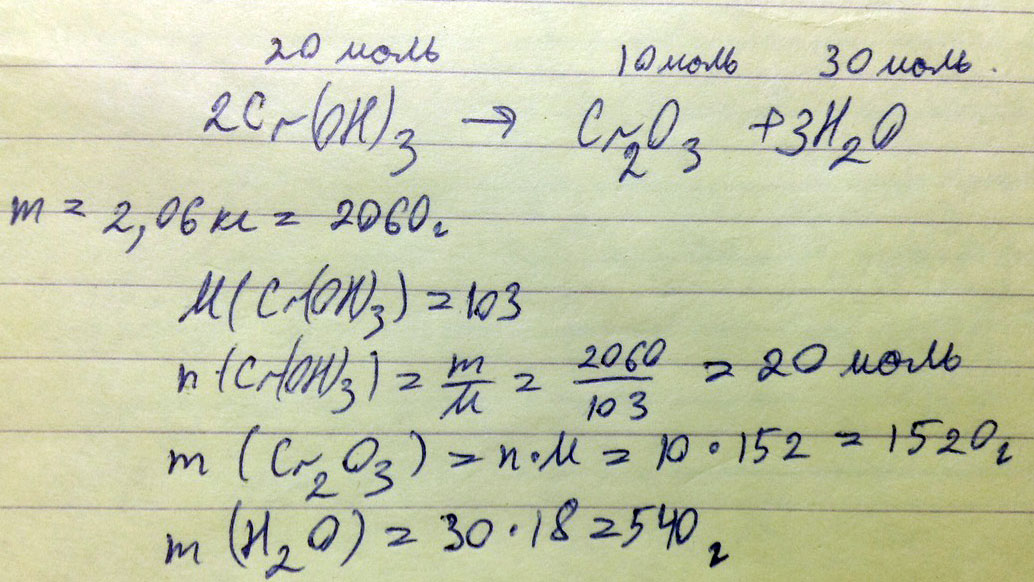
Вычислите объем кислорода, выделившегося в результате разложения 9г воды.
Дано:
m(H₂O)=9г
Найти:
V(O₂) -
Решение:
2H₂O → 2H₂ + O₂
Mr(H₂O)=1*2+16 = 18 гмоль
n(H₂O)=9г: 18гмоль = 0,5 моль
n(O₂) = n(H₂O)
1 : 2
n(O₂)= 0,5 / 2= 0,25 моль
V = Vm*n
V(О₂) = 22,4 лмоль * 0,25 моль = 5,6 л
Ответ: V(O₂) = 5,6 л
С гидроксидом кальция реагирует каждое из двух веществ:
1) оксид меди (II) и гидроксид цинка
2) оксид углерода (IV) и азотная кислота
3) сероводород и кислород
4) хлороводородная кислота и водород
211. С раствором гидроксида бария реагирует каждое из двух веществ, формулы которых:
1) Na2SО4 и СО2
2) КNО3 и FеО
3) К2О и Н2SiO3
4) Мg(ОН2 и NO
212. С раствором гидроксида кальция реагирует
1) оксид углерода (IV)
2) нитрат натрия
3) оксид магния
4) гидроксид бария
213. С раствором гидроксида натрия реагирует вещество, формула которого
1) K2S
2) NO
3) НЗРО4
4) Ва(NОЗ2
214. В результате разложения гидр оксида меди(II) образуются
1) → СuОН + Н2
2) → Сu + Н2О
3) → СuОН + Н2
4) → СuО+ Н2О
215. С гидроксидом калия не реагирует
1) соляная кислота
2) оксид бария
3) оксид углерода (IV)
4) кремниевая кислота
216. С гидроксидом бария реагирует вещество, формула которого
1) P2O5
2) NаNОз
3) СuО
4) КОН
21 7. С гидроксидом натрия реагирует
1) серная кислота
2) хлорид бария
3) оксид кальция
4) гидроксид кальция
218. С гидроксидом алюминия не реагирует раствор
1) азотной кислоты
2) гидроксида бария
3) соляной кислоты
4) сульфата натрия
219. В реакцию с азотной кислотой вступает
1) оксид серы (VI)
2) гидроксид железа (II)
3) фосфорная кислота
4) хлорид магния
220. В реакцию с разбавленным раствором серной кислоты вступает
1) медь
2) оксид кремния
3) нитрат меди (II)
4) оксид меди (II)
221. С раствором соляной кислоты не реагирует
1) оксид натрия
2) оксид углерода (IV)
3) нитрат серебра
4) гидроксид меди (II)
222. Раствор серной кислоты реагирует с каждым из двух веществ:
1) Zn и СаО
2) Mg и HCl
3) Сu(ОН2 и N2
4) BaCl2 и Н2
223. Раствор азотной кислоты реагирует с каждым из двух веществ:
1) Mg(OH)2 и СО2
2) Си и Н2О
3) СаСО3 и Na2O
4) BaSO4 и H2S
224. Раствор серной кислоты реагирует с каждым из двух веществ:
1) Nа2СО3 и СuО
2) Mg(OH)2 и HCI
3) Сu и SОз
4) BaCl2 и Н2О
225. Раствор ортофосфорной кислоты реагирует
1) КNОз
2) H2S
3) СO2
4) ВаО
226. Раствор азотной кислоты реагирует с каждым из двух веществ:
1) Zn и Сu(ОН2
2) МgО и НСl
3) NO2 и SiO2
4) Ва(NОЗ2 и Н2
227. Раствор азотной кислоты реагирует с каждым из двух веществ:
1) NаЗРO4 и SО3
2) Н3РO4 и HCI
3) СиО и Zn(OH)2
4) MgCl2 и O2
228. Раствор соляной кислоты реагирует с каждым из двух веществ:
1) АgNОз и Сu(ОН2
2) СаО и НВr
3) Hg и СO2
4) Ва(NОЗ2 и S
229. Раствор соляной кислоты реагирует с каждым из двух веществ:
1) Мg(NОЗ2 и Сu
2) Na2O и Fе(ОНз
3) Сu и H2SO4
4) Н2СОЗ и SO2
210. 2
211. 1
212. 1
213. По-моему тут подходит и 2, и 3. Хотя если нет возможности двух ответов напишите 3
214. 4
215. 2
216. 1
217. 1
218. 4
219. 2
220. 4
221. 2
222. 1
223. 3
224. 1
225. 4
226. 1
227. 3
228. 1
229. 2
В результате реакции разложения гидроксида железа (III) образуются оксид железа (III) и вода. Определите массы продуктов реакции, полученных при разложении 100 г технического гидроксида железа, содержащего 14,4% примесей.
M(Fe(OH)3)=100
14.4%
100*0.856 = 85.6
M(Fe(OH)3)=56+48+3 = 107
mol = 0.8
2Fe(OH)3 = Fe2O3 + 3H2O
Пропорция к Fe2O3
0.8/2 = x/1
x = 0.4
M(Fe2O3)=56*2+48 = 160
m(Fe2O3)=160*0.4 = 64
Пропорция к H2O
0.8/2 = x/3
x = 1.2
M(H2O)=18
m(H2O)=1.2*18 = 21.6
ответ
m(Fe2O3)=64
m(H2O)=21.6
1. Укажите формулу вещества, воспламенение, который сформировал оксида железа (ІІ):
а Fe ( SO4)3 б Fe(OH)3 в Fe(OH)2 г Fe(NO)3 д Fe(NO3)2
2. Выберите метод очистки раствора хлорида железа 2 от примесей медь 2 хлорид:
а) поместить в раствор сетку железа,
б) добавить раствор нитрата аргентум,
в) поместить в раствор цинковый диск,
г) добавить нитратную кислоту,
д) поместить в раствор серебряный диск.
3. Масса железа 21 г, содержит определенную долю примесей, обработанных хлоридной кислотой, обращается в избытке. После полного окисления газ, который был передан, использовали газ, полученный во время термического разложения 13.88 г хлората калия. Найдите и выберите массовую долю (%) примеси железа:
а 16,4% б 9,3% в 3,8% г 6,4% д 90,%
)
1. В
2. А
3.
Дано:
m’(Fe) = 21 г
m(KClO3) = 13,88 г
ω(примеси -
13.88 г х л
а 2KClO3 => 2KCl + 3O2↑
245 г 67,2 л
х=V(O2) = 3,81 л
х л 3,81 л
б 2H2 + O2 = 2H2O
2 л 1 л
х=V(H2) = 7.62 л
х г 7,6 л
в Fe + 2HCl = FeCl2 + H2↑
56 г 22,4 л
х=m(Fe) = 19,05 г - масса чистого железа
m(примесей = 21 г - 19,05 г = 1,95 г
ω(примесей = 1,95 г/21 г×100% = 9,3%
Ответ: б - 9,3%