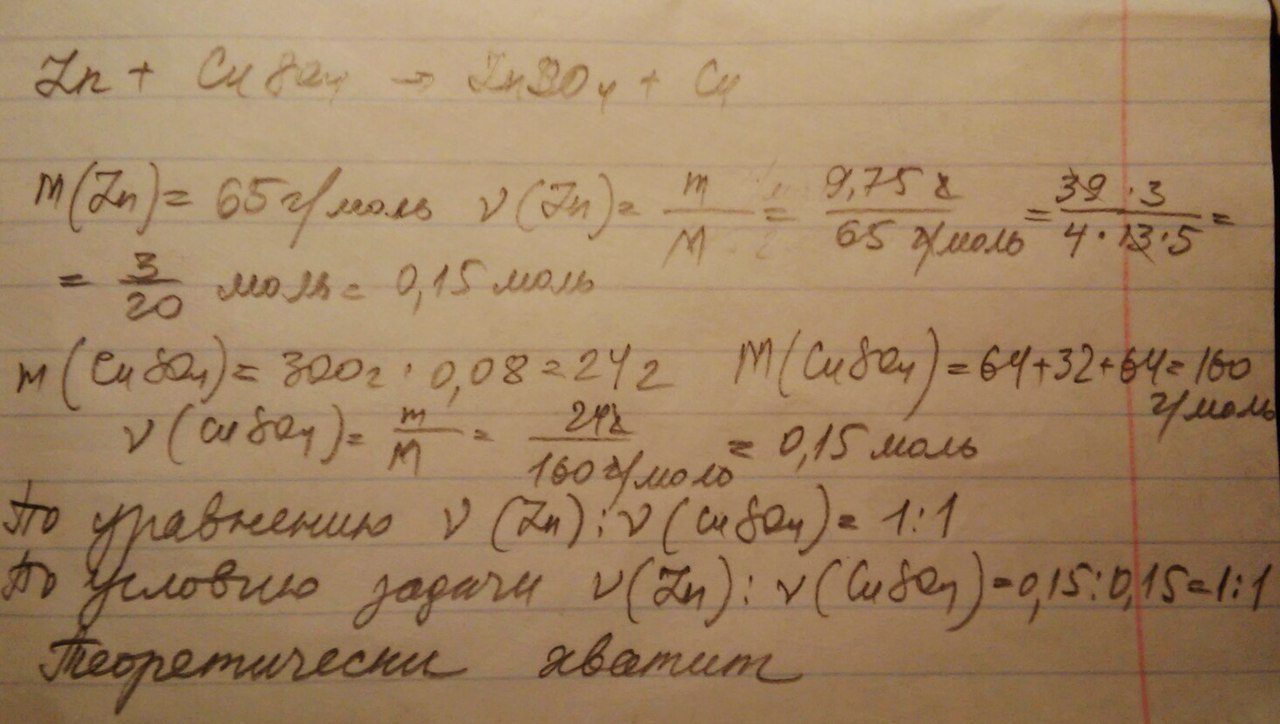Реакции замещения - задачи и примеры
Чем реакция обмена отличается от реакции разложения и замещения
В реакции обмена реагируют два сложных вещества и получается два сложных вещества. В реакции разложения из сложного вещества получается несколько простых. В реакции замещения взаимодействуют простое и сложное вещества.
8 реакций разложения, 8 реакций замещения и 8 реакций обмена.
1. Разложение
2Ag2O = 4Ag + O2
CaCO3 = CaO + CO2
(NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O
2Al(OH)3 = Al2O3 + 3H2O
2H2O = 2H2 +O2
H2SiO3 = SiO2 + H2O
4HNO3 = 4NO2+O2+2H2O
С18H38 = С9H18 + С9H20
2. Обмен
Сa(OH)2 + Na2CO3 = CaCO3↓ +2NaOH
AgNO3 + NaCl = AgCl↓ + NaNO3
CuSO4 + 2KOH = Cu(OH)2 + K2SO4
2HCl + Pb(NO3)2 = PbCl2↓ + 2HNO3
BaS + 2HCl = BaCl2 + H2S↑
СrСl3 + ЗNаОН = Сr(ОН3 + ЗNаСl.
C2H5OH + HCl = C2H5Cl + H2O
MgCl2 + K2SO4 = MgSO4 + 2KCl
3. Замещение
C6H6 +Br2 = C6H5Br + HBr
СН4+Cl2 = CH3Cl + HCl
2Аl + Fe2O3 = 2Fе + Аl2О3
Zn + 2НСl = ZnСl2 + Н2
2КВr + Сl2 = 2КСl + Вr2
2КСlO3 + l2 = 2KlO3 + Сl2
Cu+Hg(No3) = Hg+Cu(NO3)
Fe2O3 + 2Al = 2Fe + Al2O3
Приведите примеры и укажите сходство и различия в реакциях замещения и обмена
Реакция замещения: А + ВС = В + АС - реагируют простое в-во и сложное, в результате получаем также простое и сложное
Zn + 2HCl = ZnCl2 + H2
реакция обмена: АВ + СД = АД + ВС - реагируют 2 сложных в-ва и получаются 2 других сложных в-ва
(CH3COO)2Pb + KI = 2CH3COOK + PbI(золотой дождь красивая реакция
C2H4+3O2 = CO2+2H2O это реакция обмена или замещения?
Это реакция замещения.
Взаимодействие простого вещества со сложным, в результате которого образуются другие – простое и сложное – вещества: А + ВС = В + АС
Написать по 2 уравнения химических реакций.
1. СОЕДИНЕНИЯ
2. РАЗЛОЖЕНИЯ
3. ЗАМЕЩЕНИЯ
4. ОБМЕНА
Соединение CaCO3+CO+H2O = Ca(HCO3)2 Разложение NH4NO = N2+2H2O Замещение 3H2SO4+2Al = Al2(SO4)3+3H2 Обмена H2SO4+2KOH = K2SO4+2H2O
1.4P+5O2= 2P2O5 2K+Cl2 = 2KCl 2.2H2O =2H2 + O2 Cu(OH)2 = CuO + H2O 3.2Zn+2HCl = 2ZnCl + H2 2Al+6HCl = 2AlCl3 + 3H2 4.NaCl+KOH = NaOH+KCl BaCl2+Na2SO4 = BaSo4+2NaCl
Рассчитайте, достаточно ли 9,75г цинка для замещения всей меди, находящейся в 300г раствора с массовой долей сульфата меди(2) 8%
Нужно рассчитать количество вещества исходных веществ и сравнить
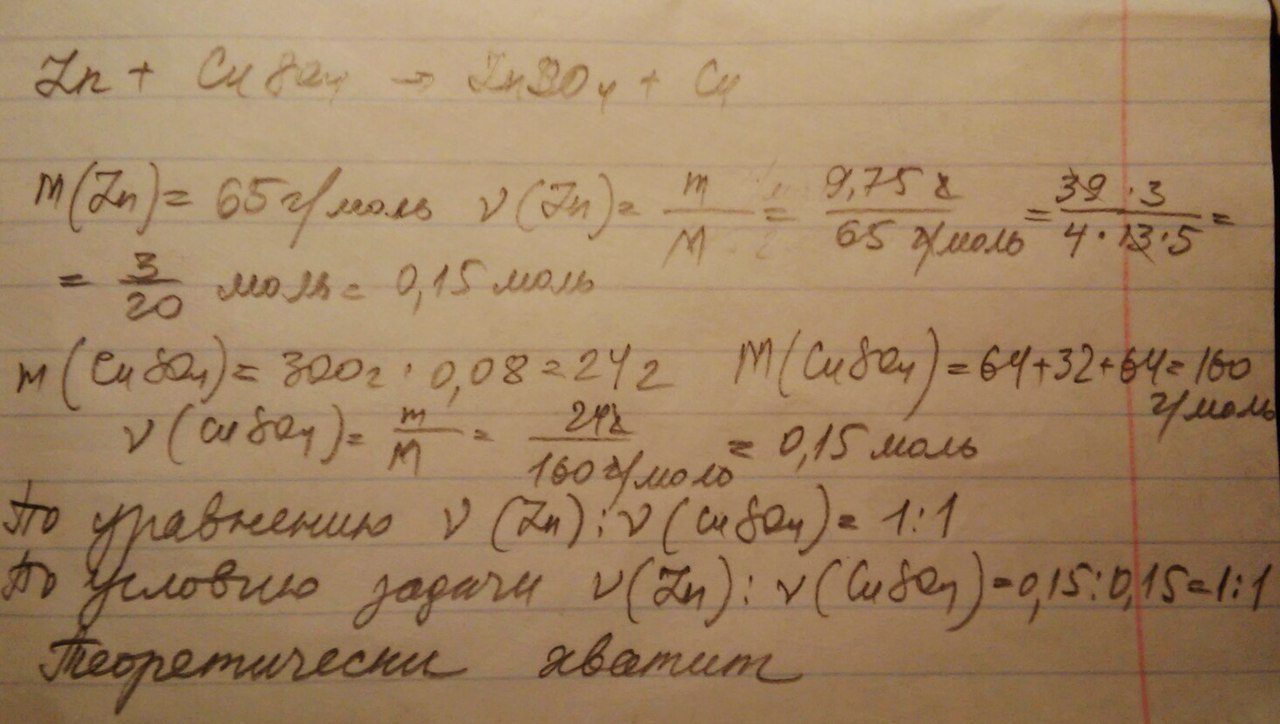
Укажите вещество, являющееся в окислителем в реакции: FeO+H2 = Fe+H2O
АFe
БH2O
ВFeO
ГH2
Реакция взаимодействия простого вещества со сложным, в результате которой образуется одно простое и одно сложное вещество называется реакцией.
АСоединения
БРазложения
ВЗамещения
ГОбмена.
Укажите вещество, являющееся в окислителем в реакции: FeO+H2 = Fe+H2OВFeO
Реакция взаимодействия простого вещества со сложным, в результате которой образуется одно простое и одно сложное вещество называется реакцией.
ВЗамещения
Чем отличается реакция обмена от реакции замещения?
Fe+CuCl2 = Cu+FeCl2это реакция замещения, в этой реакции медь ЗАМЕЩАЕТСЯ железом
CuCl2+NaOH = Cu(OH)2↓+NaCl это реакция обмена, в этой реакции медь и натрий ОБМЕНИВАЮТСЯ составными частями
Какое уравнение описывает реакцию замещения?
1) 2Al + 3S = Al 2S 3 2) 2Fe(OH)3 = Fe2O3 + 3H2O
3) Zn + 2HCl = ZnCl2 + H2 4) ZnO + 2HNO3 = Zn(NO3)2 + H O
3. Т. К. Реакция замещения- это реакция которую схематично можно описать так: А+BC = AC+B. То есть одно ПРОСТОЕ вещество(в нашем случае цинк встаёт на место другого в сложном веществе(На место H)/
H2
4) Zn(OH)2 = ZnO + H2O
К реакции обмена относится
1) Zn + CuCL2 = ZnCL2 + Cu
2) H2SO4 + Ba(NO3)2 = BaSO4 = 2HNO3
3) 2CO + O2 = 2CO2
4) 2FeCL2 + CL2 = 2FeCL3
Какое уравнение соответствует реакции замещения
1) ZnCL2 + 2AgNO3 = Zn(NO3)2 + 2AgCL
2) Zn + 2HCL = ZnCL2 + H2
3) Na2O + CO2 = Na2CO3
4) H2SO4 + Cu(OH)2 = CuSO4 + 2H2O
Сумма коэффициентов равна AI4C3 = 4AI + 3C
1) 10
2) 12
3) 8
4) 11
Реакции замещения идут по типу окислительно- восстановительных реакций. Укажите, какой из элементов является окислителем, а какой восстановителем
2FeO+C = 2Fe+CO2
CaO+H2 = Ca+H2O
SO2+2Mg = 2MgO+S
Fe+CuSO4 = FeSO4+Cu
1)
Fe(+2) +2e= Fe(0) окислитель, процесс восстановления
C(0) - 4e = C(+4) восстановитель, процесс окисления
2)
Сa(+2) +2e = Ca(0) окислитель, процесс восстановления
H2(0) - 2e = H2(+1) восстановитель, процесс окисления
3)
S(+4) +4e = S(0) окислитель, процесс восстановления
Mg(0) - 2e = Mg(+2) восстановитель, процесс окисления
4)
Fe(0) -2e = Fe(+2) восстановитель, процесс окисления
Cu(+2) +2e = Cu(0) окислитель, процесс восстановления
1) Fe-окислитель, С-восстановитель
2) Са-окислитель, Н2-восстановитель
3) S-окислитель, Мg-восстановитель