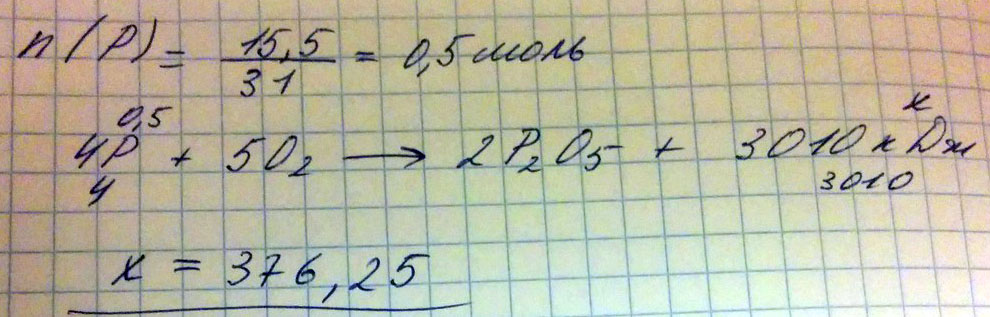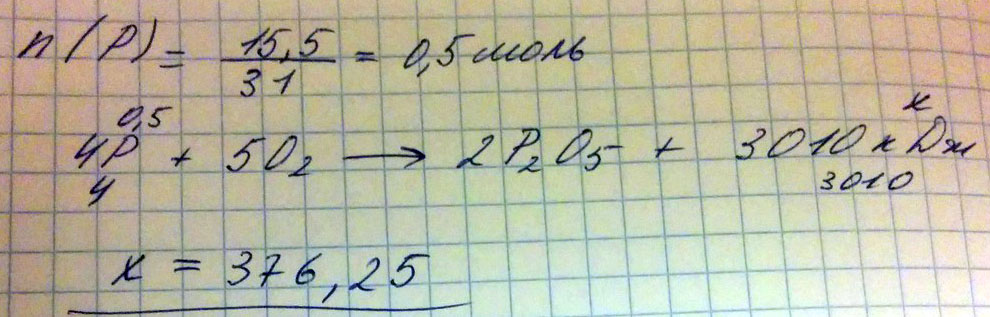Термохимические уравнения - задачи и примеры
При сжигании 1,848 г этилацетата выделилось 68,2725 кДж теплоты. Составте термохимическое уравнение реакции
M(CH3-C(=O)-O-C2H5) = 88 г/моль
1,848 г 68,2725 кДж
СН3 - С(=О-О-С2Н5 + 5О2 = 4СО2 + 4Н2О + Q
88 г х
х=88 г*68,2725 кДж/1,848 г = 3251,071 кДж
СH3 - C(=O) - O-C2H5 + 5O2 = 4CO2 + 4H2O + 3251.071 кДж
Дано термохимическое уравнение: CuO + 2HCl= CuCl2 +H2O+63,3 кДж. Согласно уравнению определите количество тепла, которое вы делится при обработке 200г оксида меди (2) соляной кислотой
а 120 кДж
в 130 кДж
с 140 кДж
д 158 кДж
е 160 кДж
Найдем количество оксида меди:
n(CuO)=200/80 = 2.5 моль
значит и количество тепла будет в 2.5 раза больше чем по уравнению, то есть:
Q = 63.3*2.5 = 158.3 кДж
Правильный ответ д
В соответствии с термохимическим уравнением 4Р(тв + 5О2(г) = 2Р2О5(тв+ 3010 кДж выделится 1505 кДж теплоты при сгорании фосфора массой. Можно решение пропорцией.
M(P)=31 г/моль
М(О2)=16 г/моль
n(P)=х моль
возьмем по уравнению 4 моль. Тогда 4/х=3010/1505. Х = 2
n(P)=2 моль
m(P)=n*M = 2*31 = 62 г.
Ответ: 62г.
Только я вообще а. Но я всегда а, а у меня лады
Напишите термохимическое уравнение реакции горения водорода, если при сгорании 1 г водорода выделилось 121 кДж теплоты.
Надо 1 кг дававить а 12 и всё
При составлении термохимического уравнения необходимо учесть, что энергия, которая выделяется или поглощается рассчитана на сгорания 2 моль водорода, поэтому 1 моль водорода имеет массу 2 г, поэтому при составлении термохимического уравнения, мы увеличиваем 121 кДж теплоты в 4 раза:
2Н2(г) + О2(г) = 2Н2О(ж + 484 кДж
Какое количество теплоты выделяется в соответствии с термохимическим уравнением C2H4(г+3O2(г)= CO2(г+H2O(г+1400 КДж при сгорании 44,8 л этена (н. у.). )
Из термохимического уравнения при сгорании
22,4 л этена (1 моль выделяется 1400 кДж, а при сгорании
44,8 л этена (2 моль выделится в 2 раза больше теплоты, т.е. 2800 кДж
Ответ: 2800 кДж
С2Н4 + 3О2 = 2СО2 + 2Н2О + 1400 кДж
Составляем пропорцию.
22,4 - 1400 кДж
44,8 - Х кДж
Х = 44,8*1400/22,4 = 2800 кДж
-
Добавка.
М = 40 * 1,05 = 42
33,6 : 22,4 = 1,5 моль СО2
27 : 18 = 1,5 моль Н2О Соотношение в углеводороде будет СхН2х 12х + 2х = 42 х = 3
С3Н6 - пропен
СН2 = СН-СН3
Какое кол-во теплоты выделится при сгорании 15,5 г фосфора? Термохимическое уравнение реакции 4Р+5О2 = 2Р05+3010кДж
Просто по уравнению подставляешь химическое количество