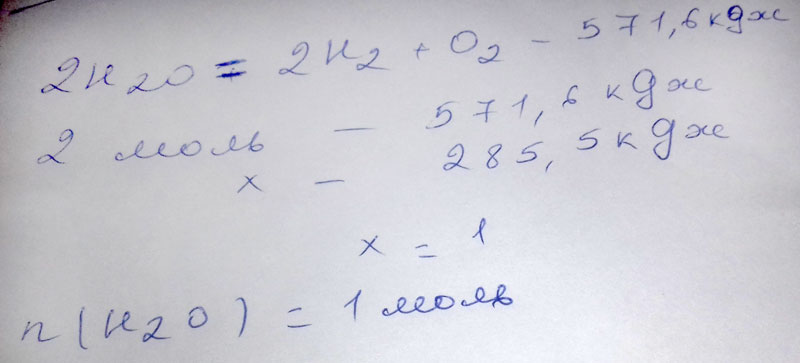Термохимические уравнения - задачи и примеры
Дано термохимическое уравнения: 2Н2O = 2H2+O2-571,6кДж. Для проведения этой реакции затрачивается 285,5кДж теплоты. Сколько молей воды при этом разложится?
Дано:
Qр-ции = -571,6 кДж
Q = -285,5 кДж
-
η(Н₂O) -
Решение:
2Н₂O = 2H₂ + O₂ - 571,6 кДж
на разложение 2 моль Н₂O затрачивается 571,6 кДж
на разложение х моль Н₂O затрачивается 285,5 кДж
х = 2 моль * (-285,5 кДж): (-571,6 кДж) = 1 моль Н₂O разложится
-
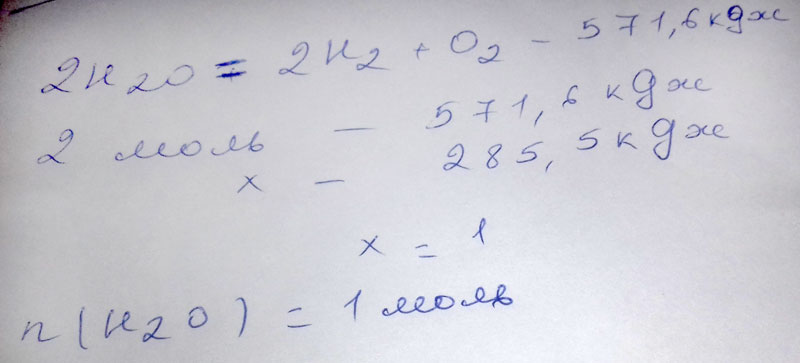
Какое количество теплоты (кДж) выделится при сжигании 8 г метана (CH4), если термохимическое уравнение горения имеет следующий вид: CH4 + 2O2 → CO2 + 2H2O + 890 кДж? В ответ запишите число, округлив его до целых.
1) Находим количества вещества метана:
M(CH₄)=12+4 = 16г/моль
n(CH₄)=m/M = 8/16 = 0,5моль
2) Находим количества теплоты при сгорании 0.5 моль метана
CH₄+2O2→CO2+2H2O+890кДж
Из уравнения реакции видно, что при сгорании 1 моль метана выделится 890 кДж теплоты, по пропорцию вычислим, сколько теплоты выделится при сгорании 0,5моль метана
1моль->890кДж
0,5моль-> Х кДж
Х = 0,5*890/1 = 445кДж
Ответ: 445 кДж
По термохимическому уравнению Mg3Na2+6H20 = 3Mg(OH)2+2NH3+690.4 кДж рассчитайте сколько энергия выделится если в результате реакция образовался аммиак объемом 4.48 л
4,48 л Х кДж
Mg3N2 + 6H2O -> 3Mg(OH)2 + 2NH3 + 690,4 кДж
n = 2 моль
Vm = 22,4 л/моль
V = 44,8 л
4,48 л NH3 - Х кДж
44,8 л NH3 - 690,4 кДж
Q = 4,48 * 690,4 / 44,8 = 69 кДж
В результате реакции, термохимическое уравнение которой 2Mg + O2 = 2MgO + 600 кДж, выделилось 150 кДж теплоты. Найти массу сгоревшего магния.
.
Х г 150 кДж
2Mg + O2 -> 2MgO +600 кДж
n = 2 моль
М = 23 г/моль
m = 46 г
Х г Mg - 150 кДж
46 г Mg - 600 кДж
m(Mg) = 46 * 150 / 600 =11,5 г
На основании термохимического уравнения горения фосфора
4P+5O2 = 2P2O5+3010кДж
рассчитайте массу сгоревшего фосфора, если в результате реакции выделилось
1) 301кДж
2) 45150кДж теплоты
4P+5O2 = 2P2O5+3010кДж
Такие задачи решаются пропорцией. Надо рассуждать так:
1) При сгорании 4 моль фосфора ( коэффициент перед фосфором стоит выделяется 3019 кДж
А сколько моль фосфора необходимо, чтобы выделилось 301 кДж?
4 моль - 3018 кДж
х моль - 301 кДж
х=4*301/3018= 0,399 моль
м(Р = n(P)*M(P)=0,399*31 = 12,4г
2) При сгорании 4 моль фосфора ( коэффициент перед фосфором стоит выделяется 3019 кДж
А сколько моль фосфора необходимо, чтобы выделилось 45150 кДж?
4 моль - 3018 кДж
х моль - 45150 кДж
х=4*45150/3018= 59,8 моль
м(Р = n(P)*M(P)=59,8*31 = 741,5г
Ответы: 12,4 г и 741,5 г
При сгорании серы получено 32г оксида серы (IV), при этом выделилось 146,3 кДж. Составьте термохимическое уравнение.
1) Запишем уравнение реакции горения серы
S+O2 = SO2
2) Рассчитаем количество вещества оксида серы
32/64= 0,5 моль
Когда сожгли 1/2 моля выделилось 146,3 кДж
Когда сожгут 1 моль- будет в 2 раза больше тепла
Итак, термохимическое уравнение: S+O2 = SO2+292,6 кДж