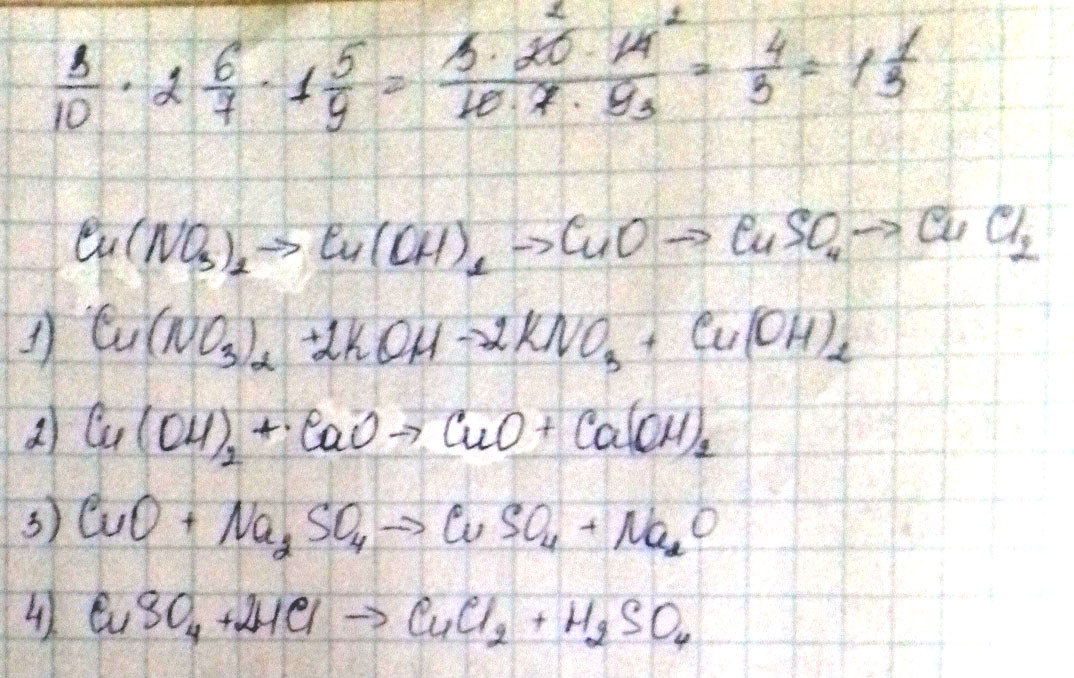Цепочки превращений - задачи и примеры
Цепочка:
1. Хлорид натрия, карбонат натрия, хлорид натрия, гидроксид натрия, натрий, сульфат натрия, хлорид натрия.
2. Калий, гидроксид калия, гидрокарбонат калия, карбонат калия, сульфат калия, хлорид калия, гидросульфат калия
1)2NaCl+CaCO3 = Na2CO3+CaCl2
2) Na2CO3+FeCl2 = 2NaCl+FeCO3
3)2NaCl+Zn(OH)2 = ZnCl2+2NaOH
4)4NaOH = 4Na+2H2O это электролиз расплава гидроксида натрия
5) натрий - очень активный металл, поэтому он сразу же реагирует с воздухом.
4Na+O2 = 2Na2O
Na2O+SO3 = Na2SO4
6) Na2SO4+BaCl2 = BaSO4+2NaCl
1)2K+2H2O = 2KOH+H2
2) KOH+CO2 = KHCO3
3)2KHCO3 = K2CO3+H2O+CO2
4) K2CO3+MnSO4 = MnCO3+K2SO4
5) K2SO4+BaCl2 = BaSO4+2KCl
6) KCl+H2SO4 = KHSO4+HCl
Цепочки по химии 9 кл.
Zn - ZnO-Zn(NO3)2-Zn(OH)2
Na-NaOH-Na2CO3-CO2
S-H2S-SO2-H2SO3-SO2
Cu-CuSO4-Cu(OH)2-CuCl2-Cu
2Zn+O2->2ZnO (с. )
ZnO+2HNO3->Zn(NO3)2+H2O (об. )
Zn(NO3)2+2KOH->2KNO3+Zn(OH)2 (об. )
2Na+2H2O->2NaOH+H2(осадок - стрелочка вверх (з. )
2NaOH+H2CO3->Na2CO3+2H2O (н. )
Na2CO3->Na2O+CO2 (р. )
S+H2->H2S (с. )
H2S+O3->SO2+H2O (з. ) (В этом на, в интернете нашла, потому что не вдуплялась
SO2+H2O->H2SO3 (с. )
H2SO3->SO2+H2O (с. )
Cu+H2SO4->CuSO4+H2(осадок - стрелочка вверх (з. )
CuSO4+2KOH->K2SO4+Cu(OH)2 (об. )
Cu(OH)2+2HCl->CuCl2+2H2O (н. )
CuCl2->Cu+2Cl (р. )
Cu(no3)2-cu(oh)2-cuo-cuso4-cucl2 осуществить цепочку.
Всё правильно, но пусть будет так
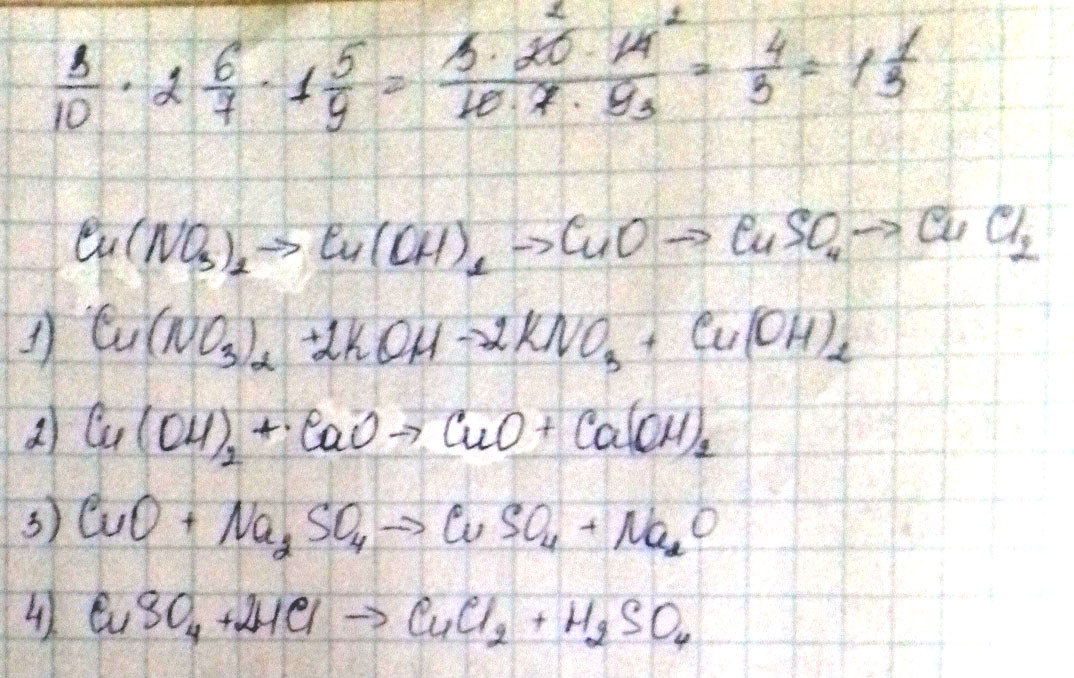
Чтобы продемонстрировать превращения веществ, Антон провёл эксперимент. Кусочек зажжённого магния Mg был помещён в тигель. По окончании реакции в тигле находился порошок белого цвета – оксид магния MgO, к которому Антон добавил немного воды. Чтобы убедиться, что оксид магния прореагировал с водой, образовав гидроксид магния Mg(OH)2, к смеси была добавлена капля раствора индикатора фенолфталеина. После того, как к образовавшейся смеси было добавлено немного раствора серной кислоты H2SO4, в тигле образовался бесцветный раствор сульфата магния MgSO4.
a) Составь цепочку превращений, которая отображает химические реакции, произошедшие в ходе эксперимента.
Mg ->.>.>.
b) Напиши уравнения химических реакций, произошедших в ходе эксперимента 1
.
.
.
c) Какие признаки протекания химических реакций можно было пронаблюдать в ходе эксперимента?
Признак протекания 1-го превращения.
Признак протекания 2-го превращения.
Признак протекания 3-го превращения.
А Mg → MgO → Mg(OH)2 → MgSO4
б 2Mg + O2 + t = 2MgO
MgO + H2O = Mg(OH)2
Mg(OH)2 + H2SO4 = MgSO4 + 2H2O
в - исчез металлический блеск, вещество побелело;
- вещество растворилось, при добавлении индикатора фф появилась пурпурная окраска, свидетельствующая о наличии щелочной среды;
- при добавлении кислоты - р-р обесцветился, произошла реакция нейтрализации и соответственно среда стала нейтральной;
Расшифруйте данную цепочку превращений, составьте к ней уравнения реакций (все вещества в цепочке содержат атомы одного и того же элемента I группы. Для уравнения 2 напишите молекулярное и ионное уравнение, а в уравнении 4 укажите окислитель, восстановитель, процессы окисления и восстановления
64-> 135-> 98-> 80-> 64
Cu → CuCl₂ → Cu(OH)₂ → CuO → Cu
1) Cu + Cl₂ = CuCl₂
2) CuCl₂ + 2KOH = Cu(OH)₂↓ + 2KCl
Cu²⁺ + 2Cl⁻ + 2K⁺ + 2OH⁻ = Cu(OH)₂ + 2K⁺ + 2OH⁻
Cu²⁺ + 2OH⁻ = CU(OH)₂
3) Cu(OH)₂↓ = CuO + H₂O
4) Cu⁺²O +H₂⁰ = Cu⁰ + H₂⁺O
H₂⁰ -1e * 2 → 2H⁺ | 2 | 1 восстановитель - процесс окисления
Cu⁺² +2e → Cu⁰ | 2 | 1 окислитель - процесс восстановления
Выполнить цепочку (поэтапно):
NaCl - Cl2 - HCl - CuCl2 - AgCl
Cl2 + H2 = 2HCl HCl + Na2CO3 = 2NaCl + CO2 + H2O 2NaCl + 2H2O = 2NaOH + H2 + Cl2 Cl2 + 2Na = 2NaCl NaCl + AgNO3 = AgCl + NaNO3
1)2NaCl+2H2O = 2NaOH+Cl2+H2 Над стрелкой напиши электролиз
2) Cl2+H2 = 2HCl
3) CuS+2HCl = CuCl2+H2S(газ
4) CuCl2+2AgNO3 = 2AgCl(осадок+Cu(NO3)2