Составьте цепочку: Mg> MgO> Mg(OH)2> Mg(NO3)2
1) 2Мg+О2 = 2МgO
2) MgO+H2O = Mg(OH)2
3) Mg(OH)2+2HNO3 = Mg(NO3)2+2H2O
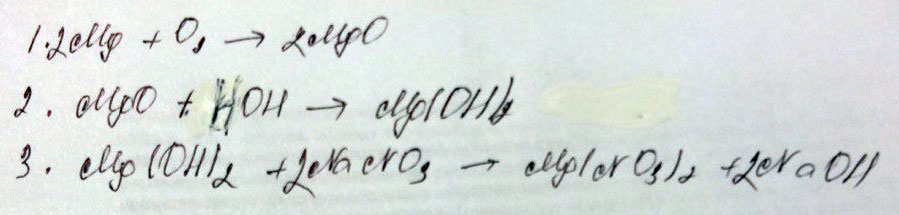
1) 2Мg+О2 = 2МgO
2) MgO+H2O = Mg(OH)2
3) Mg(OH)2+2HNO3 = Mg(NO3)2+2H2O
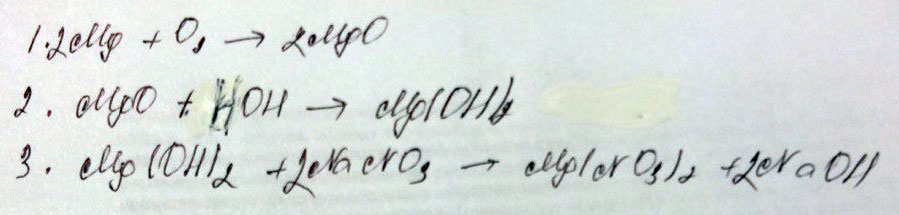
гидроксид калия → фосфат калия → фосфорная кислота → фосфат алюминия
1. 3KOH + H₃PO₄ = K₃PO₄ + 3H₂O - реакция обмена
2. K₃PO₄+ 3H₂O = 3KOH + H₃PO₄ - реакция обмена
3. Al(OH)₃ + H₃PO₄ = AlPO₄ + 3H₂O - реакция обмена
SiO2 -> Si -> SiO2 -> Na2SiO3 -> H2SiO3 -> SiO2 1. SiO2 + C -> Si + CO2 2. Si + O2 -> SiO2 3. SiO2 + 2NaOH -> Na2SiO3 + H2O 4. Na2SiO3 + 2HCl -> H2SiO3 + 2NaCl 5. H2SiO3 -> SiO2 + H2O
1. Si + O₂ = SiO₂
2. SiO₂ + 2 NaOH = Na₂SiO₃ + H₂O
3. Na₂SiO₃ + 2 HCl = H₂SiO₃ + 2 NaCl
t
4. H₂SiO₃ = SiO₂ + H₂O
5. SiO₂ + 2Mg = 2MgO + Si
1. 2Ba + O₂ = 2BaO
2. BaO + H₂O = Ba(OH)₂
3. Ba(OH)₂ + 2HCl = BaCl₂ + 2H₂O
4. H₂SO₄ + BaCl₂ = BaSO₄↓ + 2HCl
Ba→BaO→Ba (OH)2→BaCl2→BaSO4 1) Ba+O -BaO 2) BaO+2NaOH-Ba(OH)2+Na2O 3) BaOH+2HCl-BaCl2+H2O 4) BaCl2+H2SO4-BaSO4+2HCl
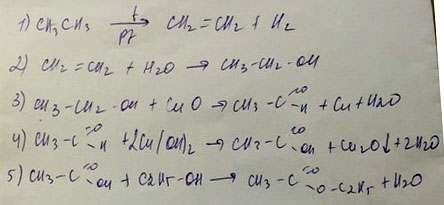
₁ ₂ ₃ ₄ ₅
Fe → Fe₂O₃ → Fe₂(SO₄)₃ → Fe(OH)₃ → Fe₂O₃ → FeCl₃
1. 4Fe + 3O₂ → 2Fe₂O₃
2. Fe₂O₃ + 3H₂SO₄ = Fe₂(SO₄)₃ + 3H₂O3. Fe₂(SO₄)₃ + 6Na(OH) = 2Fe(OH)₃ + 3Na₂SO₄
t
4. 2Fe(OH)₃ → Fe₂O₃ + 3H₂O
5. Fe₂O₃ + HCl = 2FeCl₃ + 3H₂O