Что такое ионная связь?
Ионная связь — очень прочная химическая связь, образующаяся между атомами с большой разностью (> 1,7) по шкале Полинга электроотрицательностей, при которой общая электронная пара переходит преимущественно к атому с большей электроотрицательностью. Это притяжение ионов как разноимённо заряженных тел.
Это самая прочная химическая связь. Ионная связь образуется, когда атомы металла отдают электроны с внешнего уровня атомам неметалла. В пределах периода от начала таблицы неметаллические свойства будут увеличиваться, в пределах группы от начала таблицы неметаллические свойства будут ослабевать, а металлические усиливаться.
Ионная связь - это химическая связь, образованная за счет электростатического притяжения между катионами и анионами.Такие связи в сравнительно чистом виде образуются в галогенидах щелочных металлов, например KF, так как атомы щелочных металлов имеют по одному слабо удерживаемому электрону (энергия связи примерно 3—5 эв), а атомы галогенов обладают наибольшим сродством к электрону. Но даже в кристаллах (и тем более в молекулах) этих соединений полной передачи электрона от атома металла атому галогена большей частью все же не происходит. Распространенные прежде представления об образовании в других случаях двух- трех- или четырехзарядных ионов Ca2+, C2-, B3+, Si4+ не подтвердились, так как химическая связь образуется в таких случаях более сложным путём. Для оценки степени ионности связи пользуются понятием эффективного заряда иона.
Ионная связь характерна для солей, оснований, оксидов металлов.
Примеры веществ с ионной связью: NaCl, CaO, BaF2 и т.д. Общая формула ионной связи Ме +неМЕ, где Ме - металл, неМе - неметалл.
Примеры соединений: все соли, щёлочи, гидроксиды металлов, основные оксиды. Примеры: (MgS, K2CO3), основания (LiOH, Ca(OH)2), основные оксиды (BaO, Na2O); тип решетки - металлическая.
Ионная связь характерна для веществ состава:
H2O, LiCl, SiF4, CaF2, H2S
Ионная связь (связь между металлом и неметаллом): LiCl, CaF2
Что такое ионная связь с точки зрения электролитической диссоциации?
Ионная связь в веществе говорит о его лучшей растворимости по сравнению с веществами с ковалентный связью, то есть диссоциация происходит легче. Диссоциация - распад электролита на ионы. В ковалентной решётке после гидротации элементы должны стать ионами, а здесь они уже есть.
ИОНЫ — электрически заряженные частицы, образующиеся из атома (молекулы) в результате потери или присоединения одного или нескольких электронов. Положительно заряженные ионы называются катионами, отрицательно заряженные ионы анионами.
Между какими атомами образуется ионная связь?
Ионная связь возникает между атомами, электроотрицательность которых резко различается. Рассмотрим способ образования на примере хлорида натрия NaCl. Электронную конфигурацию атомов натрия и хлора можно представить: 11 Na ls2 2s2 2p 6 3s1; 17 Cl ls2 2p 6 Зs2 3р5. Это атомы с незавершенными энергетическими уровнями. Очевидно, для их завершения атому натрия легче отдать один электрон, чем присоединить семь, а атому хлора легче присоединить один электрон, чем отдать семь. При химическом взаимодействии атом натрия полностью отдает один электрон, а атом хлора принимает его.
Схематично это можно записать так: Na. — l е —> Na+ ион натрия, устойчивая восьмиэлектронная 1s2 2s2 2p6 оболочка за счет второго энергетического уровня. :Cl + 1е ->.Cl - ион хлора, устойчивая восьмиэлектронная оболочка. Между ионами Na+ и Cl- возникают силы электростатического притяжения, в результате чего образуется соединение.
Чтобы определить, кто и сколько электронов отдал или принял - для ионной связи - нужно смотреть таблицу растворимости, где можно увидеть заряд каждого иона. Это и есть его электроны, которые он может отдать или принять (Ca 2+, означает, что он может отдать два электрона, SO4 2- может принять 2 электрона).
Схема образования ионной связи NaCl c электронами

Какая химическая связь называется ионной? Каков механизм ее образования? Какие свойства ионной связи отличают ее от ковалентной?
Ионной называют сильно поляризованную (при значительных различиях электроотрицательностей входящих в молекулу элементов) связь, когда электронная плотность практически целиком сдвинута к одной структурной единице. Ионная связь, в отличии от ковалентной, характеризуется ненаправленностью и ненасыщаемостью, а свойство поляризуемости теряет для неё всякий смысл.
Механизм образования ионной связи можно рассмотреть на примере реакции между натрием и хлором. Атом щелочного металла легко теряет электрон, а атом галогена - приобретает. В результате этого возникает катион натрия и хлорид-анион. Они образуют соединение за счет электростатического притяжения между ними.
Типичные ионные соединения: NaCl, LiF.
Уравнения превращения соответствующих ионов в нейтральные атомы:
$$ Na+ + 1e → Na0 \\ Cl- → Cl0 + 1e \\ Li+ + 1e → Li0 \\ F- → F0 + 1e $$
Опишите механизм образования ионной связи. За счет чего происходит образование этой связи?
Образуется при взаимодействии аниона и катиона (т.е. положительного и отрицательного зарядов элементов)
Ионная связь возникает за счёт электростатического притяжения между катионами и анионами, в которые превращаются атомы в результате отдачи или присоединения электронов.
Ионная связь образуется между атомами с большой разностью электроотрицательности, так что общая электронная пара полностью "перетягивается" к более электроотрицательному элементу. Таким образом в связи сохраняются ионы - одни положительные (потерявшие родной электрон), другие отрицательные (прихватившие чужой электрон). Положительные ионы при определенных условиях могут отнять электрон у другого атома, образовав с ним другое соединение.
Сформулируйте два отличия ионной связи от ковалентной
1. Ковалентная связь образована атомами неметаллов за счет общих эелектронных пар, а ионная - между металлом и неметаллом за счет статического притяжения противоположно заряженных ионов.
2. Вещества с ионной связью имеют кристаллическое строение, а с ковалентной - молекулярное.
Составьте схему образования ионной связи между атомами: Кальция и хлора; Магния и кислорода; Натрия и серы.
Ca(0) + 2Cl(0) = Ca(2+) = 2Cl(-)
2Mg(0) + 2O(0) = 2Mg(2+) + 2O(2-)
2Na(0) + S(0) = 2Na(+) + S(2-)
Цифры и знаки в скобках пишутся над элементами.
1) Ca + Cl2 ===> CaCl2
Ca(атом)(0) ===> Ca(+2)(ион) - над стрелкой нужно написать -2e
2Cl(атом)(0) ===> 2Cl(-)(ион) - над стрелкой нужно написать +1e*2
Ca(+2)Cl2(-)
2) 2Mg + O2 ===> 2MgO
2Mg(атом)(0) ===> 2Mg(+2)(ион) - над стрелкой нужно написать -2e*2
2O(атом)(0) ===> 2O(-2)(ион) - над стрелкой нужно написать +2e*2
Mg(+2)O(-2)
3) 2Na + S ===> Na2S
2Na(атом)(0) ===> 2Na(+)(ион) - над стрелкой нужно написать -1e*2
S(атом)(0) ===> S(-2e)(ион) - над стрелкой нужно написать +2e
Na2(+)S(2-)
Рассмотрите схемы образований ионной связи между атомами химических элементов : Na и O, Li и Cl, Mg и F.
1. Na (0) - 1у -> Na(+) ион натрия
О(0) + 2е ->O(-2) ион кислорода
противоположнозаряженные ионы притягиваясь, образуют молекулу Na2O
2. Li(0) -1у -> Li(+) ион лития
СI (0) + 1e->CI(-) ион хлора
образуется молекула LiCI
3. Mg(0) - 2e -> Mg(+2) ион магния
F(0) +1e -> F(-) ион фтора
молекула получается MgF2
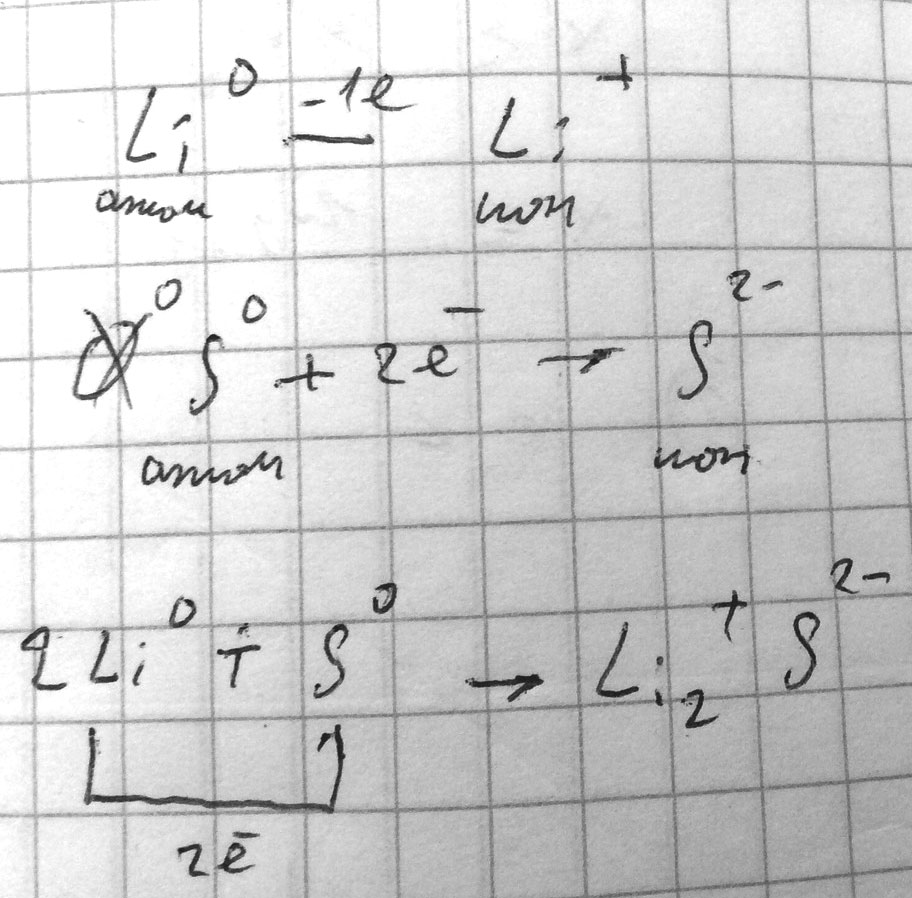
Составить схему образования ионной связи в Li2S
Составьте схему ионной связи Mg и Br
$$ Mg^{+2} + Br^{-2} $$Изобразите схемы образавания ионной связи Na2O, MgF2
$$ Na_{2}^{+} O^{2-} \\ Mg^{2+} F_{2}^{-} $$Схема образования ионной связи между атомами калия и серы
₁₉K 1s²2s²2p⁶3s²3p⁶4s¹ ₁₆S 1s²2s²2p⁶3s²3p⁴
У калия на последнем уровне 1 электрон, а у серы на последнем уровне 6 электронов и есть не заполненные орбитали( 3s²3p²3p¹3p¹). При взаимодействии калия с серой, 2 калия отдают сере два электрона на эти p-орбитали, при этом каждый калий получает заряд иона+, а сера получает заряд иона2-
K·
·
··S·· K₂⁺S²⁻
·
K·
Составить схему образования ионной связи при взаимодействии атомов натрия и серы
В образовании связи принимают участие:
один электрон атома натрия с 3s-подуровни
два электрона атома серы с 3p-подуровня.
Образуется ковалентная полярная связь (полярная потому, что связь образуют элемента с разными значениями электроотрицательности)

Покажите образование ионной связи: Cu₂O, KCl
Cu2o - оксид меди.
Cu (+2) O (-2) - ионная
Cu - 2e __> Cu (окислитель
O + 2e __> O ( восстановитель
Kcl ( ст. Окисления K = +1 a Cl = - 1)
k - 1e __> K+ (восстановитель, Катион)
Cl + 1e __> Cl (окислитель, Анион)
Составьте пары из указанных элементов, которые при химическом взаимодействии имеет максимальную тенденцию к образованию ионной связи: а) Ca; б) С; в) K; г) О; д) I; е) Cl; ж) F.
Всё зависит от электроотрицательности атомов. Чем больше разность в электроотрицательности, тем сильнее ионность связи. У фтора самая большая ЭО, а у К самая маленькая. Значит KF будет самым ионным соединением. Дальше менее ЭО будет Cl, значит KCl, ещё менее ЭО будет I, а потом С. Итак: KF-KCl-KI-CaF2-CaCl2-CaI2 -- в данном ряду уменьшается ионность слева направо
Поваренная соль- это ионная связь?
Ионная связь - это связь между катионами металлов и анионами неметаллов посредством передачи электронов в пользу неметаллов. Примером служит обычная поваренная соль - NaCl. Натрий, отдавая единственный электрон на своем внешнем уровне, "отбрасывает" этот энергетический уровень. Тем временем хлор, в свою очередь, принимает этот электрон до завершения на внешнем уровне до 8 электронов. Обычно эта связь очень прочная.
Укажите пару химических элементов, между которыми может возникнуть ионная связь
А. Водород и кислород
Б. Фтор и углерод
В. Литий и хлор
Г. Хлор и хлор
В. Литий и хлор
Li +3 )2 )1
Cl +17)2 )8 )7
Литий отдает свой 1 электрон с последнего слоя Хлору, которому не хватает этого электрона. ПОЛУЧАЮТСЯ ИОНЫ!
[ Li +3 )2 ]+ катион
[ Cl +17 )2 )8 )8 ]- анион
Li - 1e → Li+
Cl + 1e → Cl-
Рассмотрите схемы образования ионной связи между атомами химических элементов: а) калия и кислорода; б) лития и хлора; в) магния и фтора.
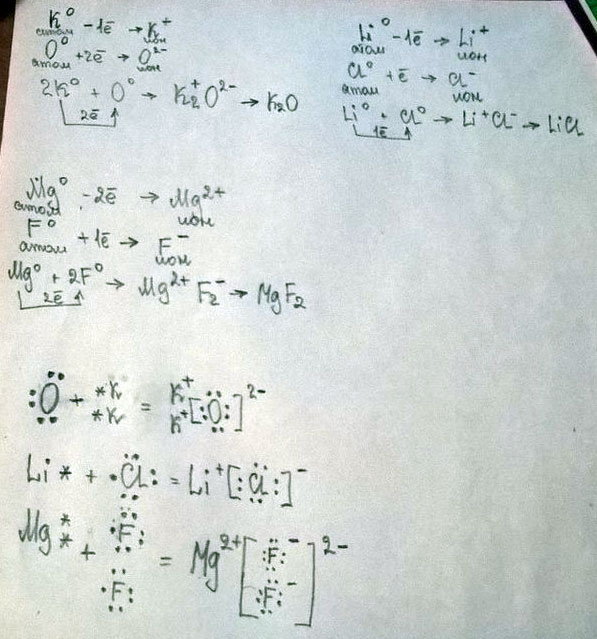
В каких из этих соединений имеется ионная связь F2 Al2O3 NACL P2O5 NaF CаO KCL
F2 - это ковалентно неполярная связь
Al2O3 - ионная связь
NaCl - ионная связь
P2O5 - ковалентно неполярная связь
NaF - ионная связь
CaO - ионная связь
KCl - ионная связь.
Ионная связь LiF
1e
____
| |
0 0 + -
Li + F -> LiF
механизм образования ионной связи.
Литий отдает 1 электрон фтору. При этом образуются положительно заряженный ион лития и отрицательно заряженный ион фтора. Эти ионы притягиваются электростатически, образуя данную связь
Как определить молекулы (по связи)? Ионная связь, ковалентная связь, ковалентная донорно-акцепторная связь, металлическая связь и водородная связь.
NaCl
HCl
Na2O
CaCl2
S8
P4?
В NaCl у Na ЭО=1,01 Cl=3,0 (Связь, в которой электроотрицательность резко отличается, называется ионной связью.) HCl ковалентная полярная связь. (2,1-3,0=-0,9), смещение в сторону хлора. Na2O - ионная, CaCl2 - ионная
S8 - ковалентная неполярная, P4 - ковалентная неполярная.
Выберите формулы с ионным типом связи: HJ, CO2, Na2O, KF. Объясните, что такое ионная связь и как она определяется?
Ионная связь возникает между металлами и неметаллами. Электроотрицательность неметаллов высокая и они оттягивают электроны от металлов. В результате этого процесса металлы превращаются в ион, получают заряд иона "+", а неметаллы превращаются в ион с зарядом "-". Межу ними возникает ионная связь и такие вещества имеют ионную кристаллическую решетку. В предложенном задании у веществ, формулы которых: Na2O и KF ионный тип связи. Na2⁺O⁻², K⁺F⁻
Ионная связь не характерна для соединения, образованного атомами: 1) бария и серы; 2)натрия и хлора; 3) фосфора и хлора; 4) кальция и фтора?
Не характерна для 3)
Здесь будет ковалентная полярная
Ионная связь - это связь между элементами, которые резко отличаются электроотрицательностью. Эта связь характерна для оксидов, солей, щелочей, то есть веществ, образованных металлом и неметаллом.
В данной задаче ответ 3, потому что данное вещество образовано двумя неметаллами
Напишите схему ионной связи алюминия и хлора
AlCl3. От алюминия идет переход электронов к хлору. Атом алюминия превращается в положительно заряженный ион, а атом хлора приобретает отрицательный заряд:
Al(0) + Cl(0) → Al(3+) + Cl(1-)
или: Al(0) -3e → Al(3+)
Cl(0) +1e → Cl(1-)
Обоснуйте утверждение "металлическая связь отличается от ионной связи"
Металлическая решетка присутствует ТОЛЬКО у металлов. Например: Fe, Cu.
Ионная - в хим. соединениях, где присутствует металл и неметалл. Например: NaCl. Na это металл, а Cl неметалл.
Составьте схему образования ионной связи в веществах: MgBr2, AlCl3
Бром и хлор лучше притягивают электроны и таким образом, при образовании химической связи между магнием и бромом, и между алюминием и хлором, возникает ионная связь. Магний отдает на образование химической связи 2 электрона, а каждый атом брома (там их два) по одному электрону, общая пара электронов оттягивается к атомам брома, и каждый атом брома приобретя лишний электрон, заряжается -1, а атом магния, отдав два электрона, +2:
Br :Mg : Br электронная плотность оттягивается к атомам брома
-1Br-Mg+2-Br-1
Так же и с алюминием и тремя хлорами:
Cl : Al : Cl Al+3 и Cl-1 степени окисления
: Cl
Электронная плотность стягивается к атомам хлора от атома алюминия.
Mg⁰-2e=Mg⁺² 2Br⁰+2e=2Br⁻ Магний отдаёт 2 электрона и получает заряд+2. Два брома получают по 1 электрону от магния и получают заряд -1. Связь осуществляется за счёт сил электростатического притяжения (+ к-).
Аналогично Al⁰-3e=Al⁺³ 3Cl⁰+3e=3Cl⁻ Алюминий отдаёт 3 электрона, а 3 хлора их принимают. Связь осуществляется за счёт сил электростатического притяжения (+ к-).
Механизм образования ионной связи в молекулах сульфида натрия Na2S
Натрий одновалентен, значит пишем рядом с натрием одну точку, сера шестивалентна, но у серы по формуле (8-валентность эл) два не парных электрона, значит расписываем вокруг серы 4 парных и 2 непарных электрона. Дальше, у серы два непарных электрона, значит пишем два натрия (у натрия только один непарный электрон) После взаимодействия при получении сложного вещества объединяем спаренные электроны.
Механизм образования ионной связи в молекулах бромида калия KBr
K⁰ + Br⁰ ⇒ K⁺ + Br⁻ ⇒ KBr (калий отдает брому единственный электрон с внешнего энергетического уровня, а бром принимает этот электрон, завершая свой внешний энергетический уровень). Связь - ионная