Химические реакции по изменению числа исходных и конечных веществ подразделяют на:
- Реакции соединения - реакции, при которых из двух или нескольких веществ образуется одно новое вещество: $$ NH_3 + HCl = NH_4Cl \\ CaO + CO_2 = CaCO_3$$
- Реакции разложения - реакции, в результате которых из одного вещества образуется несколько новых веществ: $$ C_2H_5Br = C_2H_4 + HBr \\ Hg(NO_3)_2 = Hg + 2NO_2 + O_2 $$
- Реакции замещения - реакции, в результате которых атомы простого вещества замещают в молекулах других веществ: $$ Zn + CuSO_4 = Cu + ZnSO_4 \\ Cu + 4HNO_3 = Cu(NO_3)2 + 2NO_2 + 2H_2O $$
- Реакции обмена - реакции, в результате которых два вещества обмениваются атомами или группировками атомов, образуя два новых вещества: $$ CaO + 2HCl = CaCl_2 + H_2O \\ KCl + AgNO_3 = AgCl + KNO_3 $$
При необратимых реакций продукты реакции уходят из сферы реакции (выпадают в осадок, выделяются в виде газа, образуются малодиссоциирующее соединения или выделяется большое количество энергии).
Также существуют реакции нейтрализации — это реакции между основанием и кислотой, в результате образуются соль и вода (\(KOH + HCl → KCl + H_2O\)); и окислительно-восстановительные реакции, в которых элементы меняют степень окисления.
Классификация химических реакций по различным признакам
В качестве классификационных признаков могут быть выбраны следующие:
- Число и состав исходных веществ и продуктов реакции.
- Агрегатное состояние реагентов и продуктов реакции.
- Число фаз, в которых находятся участники реакции.
- Природа переносимых частиц.
- Возможность протекания реакции в прямом и обратном направлении.
- Знак теплового эффекта разделяет все реакции на: экзотермические реакции, протекающие с экзо-эффектом - выделение энергии в форме теплоты \((Q \gt0, ∆H \lt 0):\;\;\;С + О_2 = СО_2 + Q\)
и эндотермические реакции, протекающие с эндо-эффектом - поглощением энергии в форме теплоты \((Q \lt 0, ∆H \gt 0):\;\;\; N_2 + О_2 = 2NО - Q\)
Такие реакции относят к термохимическим.
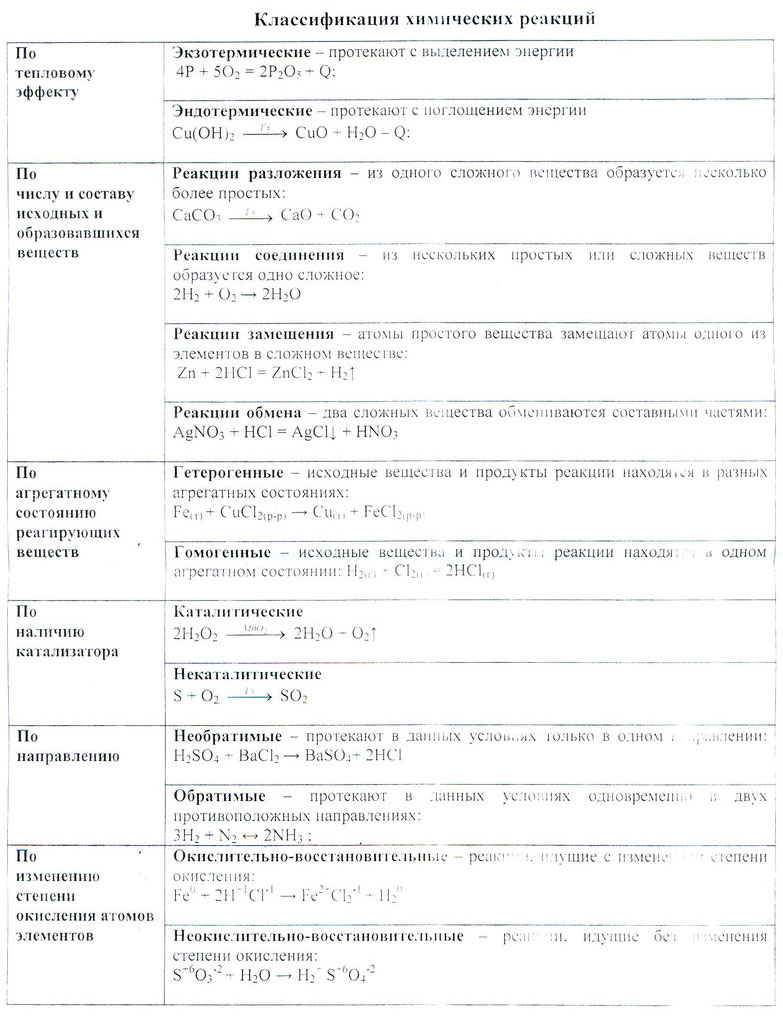
Классификация химических реакций по различным признакам (агрегатному состоянию веществ, тепловому эффекту, использованию катализатора, направлению протекания)
Агрегатное состояние:
Гомогенные С + O2 = СO2
Гетерогенные Na + Cl2 = NaCl
тепловой эффект:
Экзотермические 2Mg + O2 = 2MgO + Q
Эндотермические Zn(OH)2 = ZnO + H2O - Q.
По использованию катализатора:
Каталитические 2So2+O2 (=) 2So3 катализатор V2O5
некаталитические 2NO + O2 = 2NO2
Направление протекания:
Необратимые SiO2 + H2O = H2SiO3↓
Обратимые 3H2 + N2 ⇌ 2NH3.
(Реакции в сторону образования продуктов - прямые. В сторону реагентов - обратные)