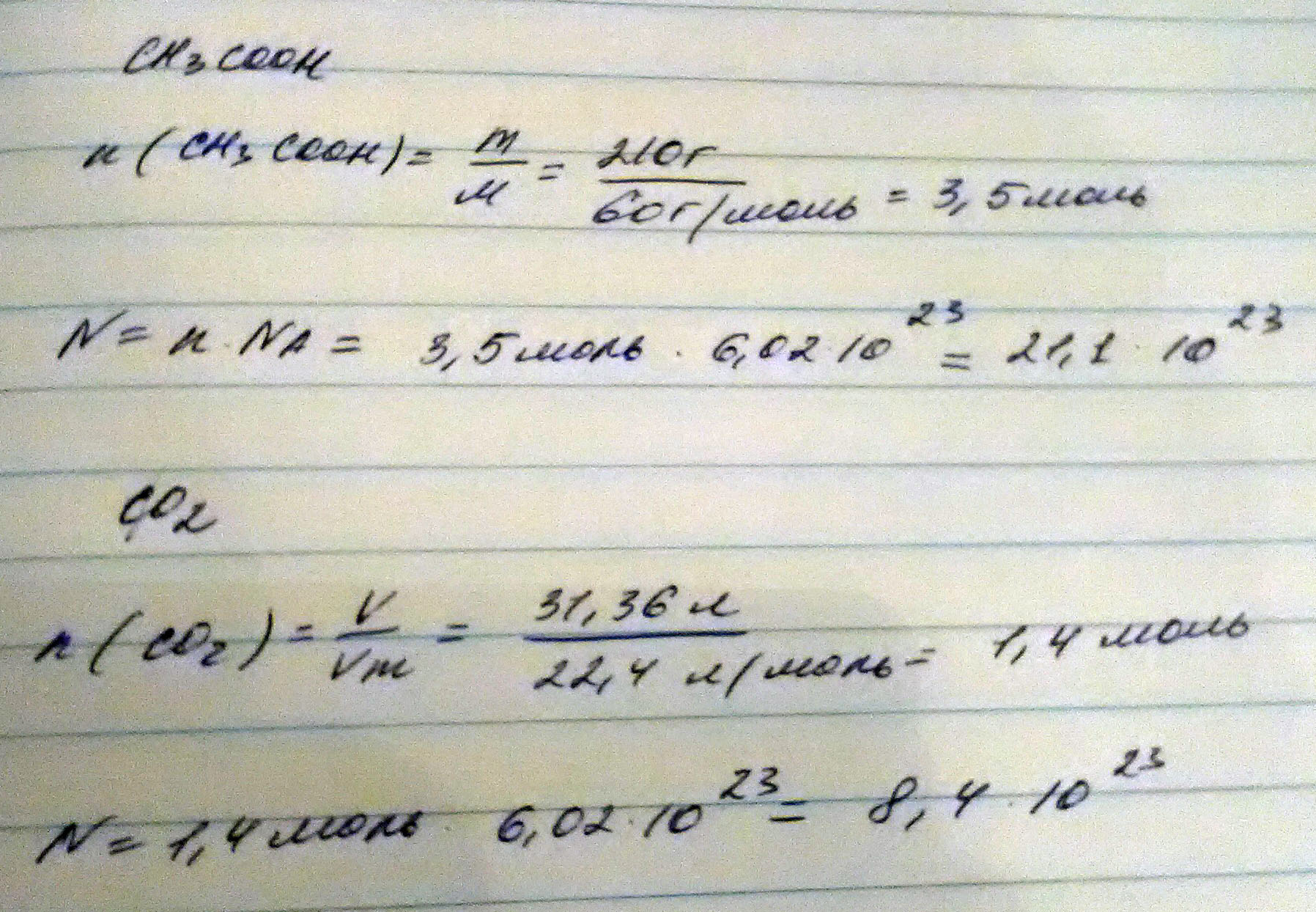Найти число молекул - задачи и примеры
Рассчитайте массу и число молекул кислородного соединения фосфора(3) количеством вещества 5 моль.
Вещество: P₂O₃
Молярная масса: 110 г/моль
Количество в-ва: 5 моль
Вычислим массу: m(P₂O₃) = 5 моль × 110 г/моль = 550 г.
Число молекул: N(P₂O₃) = 5 моль × 6.02 × 10²³ = 3,01 × 10²⁴ молекул
Рассчитайте массу и число молекул кислородного соединения фосфора (lll) количеством вещества 5 моль.
Вещество: P₂O₃
Молярная масса: 110 г/моль
Количество в-ва: 5 моль
Вычислим массу: m(P₂O₃) = 5 моль × 110 г/моль = 550 г.
Число молекул: N(P₂O₃) = 5 моль × 6.02 × 10²³ = 3,01 × 10²⁴ молекул
Одинаковое ли число молекул составляют 32г метана CH4 и 32г оксида серы (IV)? И как это все записать?
N(CH4) = кол-во вещества*число Авогадро = 2 * 6*$$ 10^{23} $$
кол-во вещества = m / M = 32 / 96 = 0,33 моль
Ответ: нет
Вычислите число молекул метана ch4 и объем метана количеством веществ равном 100 моль
В одном моле в-ва 6,02х10^23 молекул, следовательно в 100 моль их 6,02х10^23моль^(-1) х100моль= 602х10^23 молекул метан -газ, а объем одного моля газа составляет 22,4 л/моль, тогда объем 100 моль = 22,4 л/моль х 100 моль=2240 л Дано: ню(СН4)=100моль N a(число Авогадро =6.02х10^23 моль^(-1) V(одного моля газа= 22.4л/моль Найти: N(CH4 в 100 моль- V(100 моль СН4)- Решение: N(СН4)=6,02х10^23моль^(-1) х100моль= 602х10^23 молекул V(CH4)= 22,4 л/моль х 100 моль=2240 л
Найти число молекул в образцах следующих веществ:
а) 210 г уксусной кислоты б) 31,36 л углекислого газа
,
N = m/M*N(A), M(H2CO3)=62g/mol
N(H2CO3)=210/62*6.02*10^23 = 2.04*10^24 молекул
N(CO2)=V/Vm*N(A)=31.36/22.4*6.02*10^23 = 8.4*10^23 молекул
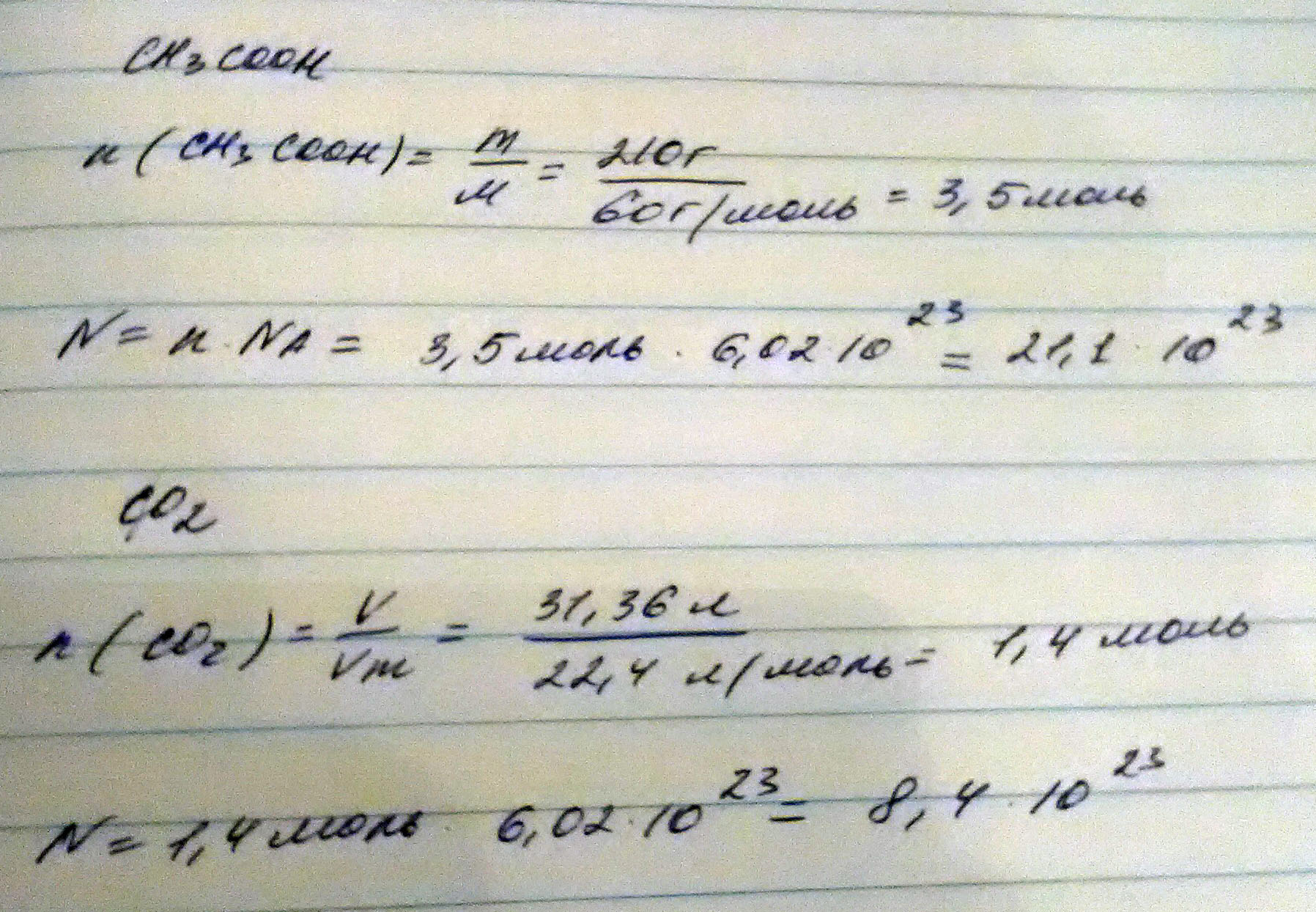
Рассчитайте число молекул, содержащихся в 56 л углекислого газа:
V = Vm*n
Vm = 22.4 л/моль
n = V/Vm = 56 л / 22,4 л/моль = 2,5 моль
найдем число молекул СО2 в 2,5 моль:
1 моль СО2 - 6,02*\( 10^{23}\) молекул