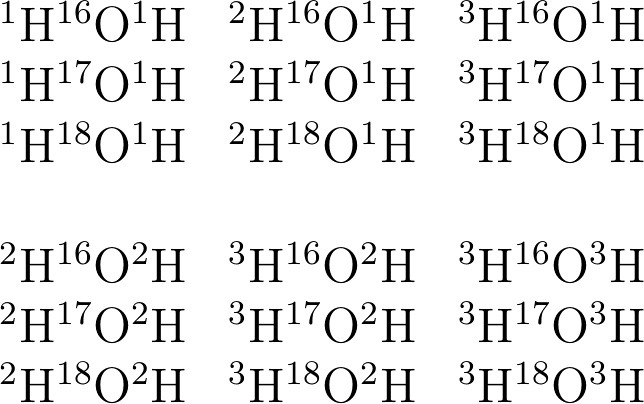Изотопы - задачи и примеры
Как определить число протонов, нейтронов и электронов в атоме? Назовите изотопы Гидрогена. Чем они отличаются?
Чтобы определить число протонов, нужно посмотреть на порядковый номер. Например порядковый номер фосфора равен 15, значит и протонов будет 15. Столько же и электронов, т. к. Число протонов ВСЕГДА равно числу электронов.
Чтобы найти число нейтронов, нужно от относительной массы отнять порядковый номер
Почему изотопы хлора одинаковы между собой по свойствам, тогда как свойства изотопов водорода равняется
Потому что атомная масса водорода гораздо меньше массы хлора. К ваодороду прибавишь один нейтрон - и он в два раза тяжелее становится. С хлором такое не прокатит
Учитывая, что для водорода известны изотопы 1H, 2H(Д 3H(Т, а для кислорода 16О, 17О и 18О, выпишите все возможные формулы воды (18 формул. Укажите среди них самую "легкую" и самую "тяжелую" воду, подсчитайте их молекулярные массы.
Для удобства видимости всех изотопов, формулу воды будем изображать в виде НОН (решение на рисунке.
Самая "легкая" вода ¹H¹⁶O¹H (Mr = 1+16+1 = 18, т.е. Самая обыкновенная вода и есть самой легкой
Самая "тяжелая" вода ³H¹⁸O³H (Mr = 3+18+3 = 24)
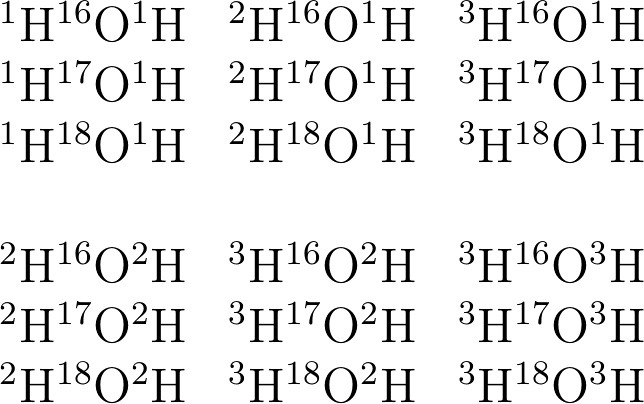
Найти изотопы углерода,
Углерод имеет два стабильных изотопа — 12C и 13C. Содержание этих изотопов в природном углероде равно соответственно 98,93 % и 1,07 %. Известны также 13 радиоактивных изотопов углерода (от 8C до 22C), из которых один — 14C — встречается в природе (его содержание в атмосферном углероде около 10−12).
Строение атома. Состав атомного ядра. Изотопы
Понятие атом возникла в древнем мире для обозначения частиц вещества. В переводе с греческого означает "неделимый". После открытие явления радиоактивности было доказано что атом имеет сложное строение, состоит из более мелких элементарных частиц. Резерфорд предложил планетарную модель атома (Аналогично солнечной системе. Атомное ядро, в котором сосредоточена вся масса атомов состоит из протонов и нейтронов. Протоны имеют заряд равный + 1 и массу равную 1. Нейтроны не имеют заряда имеют массу равную массе протона (=1). Электроны вращаются вокруг положительно заряженного ядра, имеют заряд -1 и маленькую массу, которой можно пренебречь. Суммой протонов и нейтронов называется массовое число. Так как атом электронейтрален, то число протонов и электронов в атоме одинаково. Оно равно порядковому номеру элемента. Порядковый номер элемента определяет: 1. Общее число электронов в атоме,
2. Число протонов в ядре атома,
3. Число нейтронов равно разности относительной атомной массы (Ar) и порядкового номера.
С точки зрения строения атома, химический элемент- это совокупность атомов с одинаковым зарядом ядра.
Разновидности атомов одного и того же элемента, имеющие одинаковый заряд ядра, но разное массовое число, называются изотопами. Изотопы существуют в природе и их можно получить в результате ядерных реакций. Химические элементы, встречающиеся в природе, являются смесью изотопов. С (углерод имеет 3 изотопа: +6С12, +6С13, +6С14 (+6-иднекс слева внизу; 12,13,14- степени слева наверху. Для водорода H известны три изотопа: +1Н1- протий, +1Н2- дейтерий, +1Н3- тритий (+1-иднекс слева внизу, 1,2,3- степени слева наверху. Ядерные реакции происходят на солнце а также научились проводить их на Земле. Изотопы одного и того же элемента имеют разные относительные атомные массы, поэтому относительная атомная масса химического элемента является средним значением атомных масс природных изотопов с учётом их содержания в природе.
Ar (Cl)= 35,5
35^Cl; 37^Cl.
Ar (Cl)= 35,5×0,75+37×0,25/2 = 35,5.
Основные сведения о строении атомов. Состав атомного ядра. Изотопы
Атом состоит из электронов и ядра(которая состоит из протонов и нейтронов и элементарных частиц.
Ядро содержит положительно заряженные протоны и нейтроны(нейтральная т.е. Незаряженная.
Число протонов-порядковый номер в периодической таблице и заряд ядра.
Изотопы (одинаковый заряд, разные массы то есть нейтронов в изотопах больше. Например изотоп 81Br отличается от 80Br одним нейтроном.