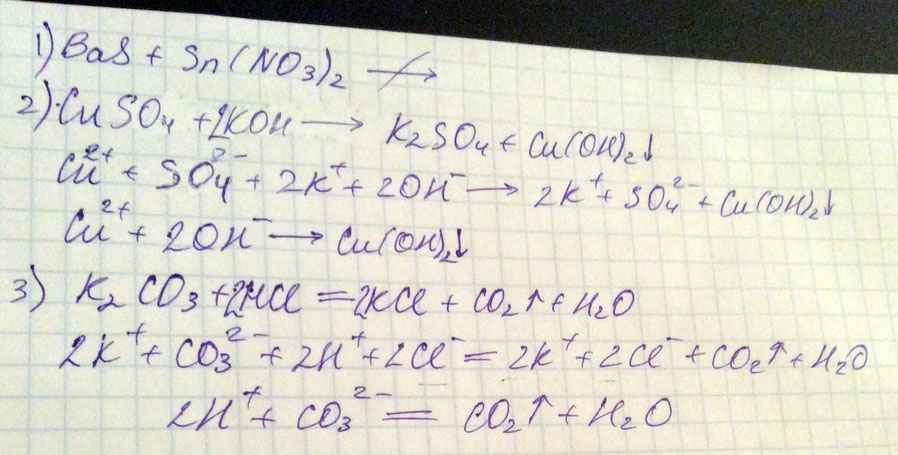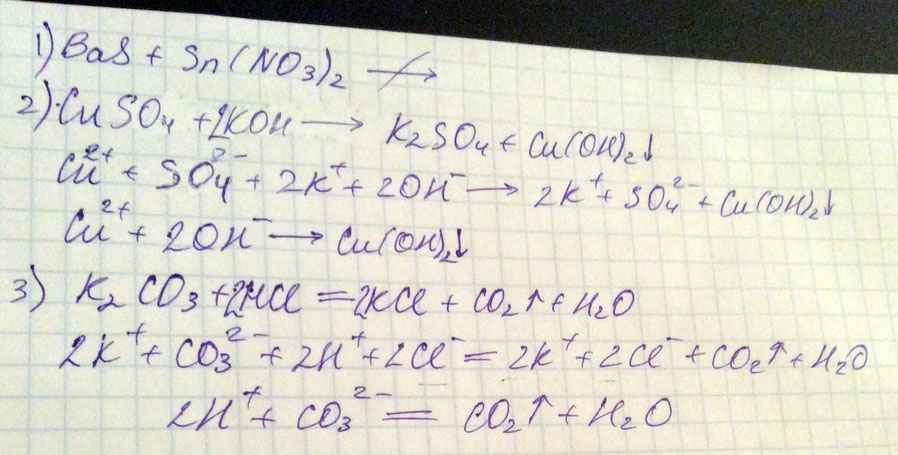Запишите уравнения реакций в молекулярном - задачи и примеры
1) Напишите уравнения возможных реакций соляной кислоты со следующими веществами:
K2SiO3, KOH, Ag, ZnS, Cr2(SO4)3, Mg, SO2, Al2O3.
Приведите уравнения реакций в молекулярном и ионном виде.
2) Напишите уравнения возможных реакций раствора серной кислоты со следующими веществами:
NaNO3, Ba(OH)2, Al, MgCO3, Cr2O3, Hg, BaCl2, N2O3.
Приведите уравнения реакций в молекулярном и ионном виде.
K2SiO3 +2 HCl = 2KCl + H2SiO3
2K(+) + SiO3(-2) + 2H(+) + 2Cl(-) = 2K(+) + 2Cl(-) + H2SiO3
SiO3(-2) + 2H(+) = H2SiO3
KOH + HCl = KCl + H2O
K(+) + OH(-) + H(+) + Cl(-) = K(+) + Cl(-) + H2O
H(+0 + OH(-) = H2O
ZnS + 2HCl = ZnCl2 + H2S
ZnS + 2H(+) + 2Cl(-) = Zn(+2) + 2Cl(-) + H2S
ZnS + 2H(+) = Zn(+2) + H2S
Mg + 2HCl = MgCl2 + H2
Mg(0) + 2H(+) + 2Cl(-) = Mg(+2) + 2Cl(-) + H2
Mg(0) + 2H(+) = Mg(+2) + H2(0)
Al2O3 +6 HCL = 2AlCl3 + 3H2O
Al2O3 + 6H(+) + 6Cl(-) = 2Al(+3)+ 6Cl(-) + 3H2O
Al2O3 + 6H(+) = 2Al(+3) + 3H2O
2) Ba(OH)2 + H2SO4 = BaSO4 + 2H2O
Ba(+2) + 2OH(-) + 2H(+) + SO4(-2) = BaSO4 + 2H2O
2Al + 3H2SO4 = Al2(SO4)3 + 3H2
2Al(0) + 6H(+ )+ 3SO4(-2) = 2Al(+3) + 3SO4(-2) + 3H2(0)
2Al(0) + 6H(+) = 2Al(+3) + 3H2(0)
MgCO3 + H2SO4 = MgSO4 + CO2 + H2O
MgCO3 + 2H(+) + SO4(-2) = Mg(+2) + SO4(-2) + CO2 + H2O
MgCO3 + 2H(+) = Mg(+2) + CO2 + H2O
Cr2O3 +3 H2SO4 = Cr2(SO4)3 + 3H2O
Cr2O3 + 6H(+) + 3SO4(-2) = 2Cr(+3) + 3SO4(-2) + 3H2O
Cr2O3 + 6H(+) = 2Cr(+3) + 3H2O
BaCl2 + H2SO4 = BaSO4 + 2HCl
Ba(+2) + 2Cl(-) + 2H(+) + SO4(-2) = BaSO4 + 2H(+) + 2Cl(-)
Ba(+2) + SO4(-2) = BaSO4
1) с каким из перечисленных веществ будет реагировать гидроксид натрия: азотная кислота, оксид кальция, оксид углерода (4), гидроксид меди, хлорид алюминия? Напишите уравнения возможных реакций в молекулярном и ионном виде.
2) напишите уравнения реакций взаимодействия натрия с простыми веществами: кислородом, хлором, серой, бромом. Дайте названия образующимся веществам.
3) как доказать что в одном из двух растворов есть ионы Al^3+, а в другом-ионы Ba^2+? Напишите уравнения протекающих реакций.
4) к 89 г раствора хлорида алюминия с массовой долей 15,0% добавили избыток раствора нитрата свинца. Определите массу выпавшего осадка.
1) NaOH + HNO3 = NaNO3 + H2O
Na(+) + OH(-) + H(+) + NO3(-) = Na(+) + NO3(-) + H2O
OH(-) + H(+) = H2O
2NaOH + CO2 = Na2CO3 + H2O
2Na(+) + 2OH(-) + CO2 = 2Na(+) + CO3(-2) + H2O
2OH(-) + CO2 = CO3(-2) + H2O
AlCl3 + 3NaOH = Al(OH)3 + 3NaCl
Al(+3) + 3Cl(-) + 3Na(+) + 3OH(-) = Al(OH)3 + 3Na(+) + 3Cl(-)
Al(+3) + 3OH(-) = Al(OH)3
2) 2Na + O2 = Na2O2 (пероксид натрия
2Na + Cl2 = 2NaCl ( хлорид натрия
2Na + S = Na2S ( сульфид натрия
2Na + Br2 = 2NaBr ( бромид натрия
3) AlCl3 + 3NaOH = Al(OH)3 + 3NaCl ( желеобразный осадок белого цвета, растворяется в избытке раствора щелочи
BaCl2 + H2SO4 = BaSO4 + 2HCl ( белый осадок
Даны вещества: Ag, HNO3(раствор, ZnSO4, Ba(OH)2, SO3, Na2CO3, Mg. Выбрать из этого списка вещества, которые могут взаимодействовать с: аHCl, бKOH. Составить уравнения возможных реакций в молекулярном и ионном виде.
Ba(OH)2 + 2HCl = BaCl2 + 2H2O
Ba²⁺+2OH⁻+2H⁺+2Cl⁻ = Ba²⁺+2Cl⁻+2H₂O
2OH⁻+2H⁺ = 2H₂O
OH⁻+H⁺ = H₂O
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
2Na⁺+CO₃²⁻+2H⁺+2Cl⁻ = 2Na⁺+2Cl⁻+H₂O+CO₂↑
CO₃²⁻+2H⁺ = H₂O + CO₂↑
Mg + 2HCl = MgCl2 + H2
KOH + HNO3 = KNO3 + H2O
K⁺+OH⁻+H⁺+NO₃⁻ = K⁺+NO₃⁻+H₂O
OH⁻+H⁺ = H₂O
2KOH + ZnSO4 = K2SO4 + Zn(OH)2↓
2K⁺ + 2OH⁻ + Zn²⁺ + SO₄²⁻ = 2K⁺ + SO₄²⁻ + Zn(OH)₂↓
2OH⁻ + Zn²⁺ = Zn(OH)₂↓
2KOH + SO3 = K2SO4 + H2O
Закончите уравнения практически осуществимых реакций в молекулярном и ионном виде:
а HNO3+Ba(OH)2 -
б AgNO3+K3PO4 -
в BaCO3+HCL -
г Na2CO3+KCL -
д Fe(OH)3+H2SO4 -
е BaSO4+HNO3 -
ж Na2SO4+Pb(NO3)2 -
1)2HNO3+Ba(OH)2 = 2H2O+Ba(NO3)2
2H+2NO3+Ba+2OH = 2H2O+Ba+2NO3
H+OH = H2O(я сразу коэффициенты сократил
2)3AgNO3+K3PO4 = Ag3PO4(осадок+3KNO3
3Ag+3NO3+3K+PO4 = Ag3PO4+3K+3NO3
3Ag+PO4 = Ag3PO4
3) BaCO3+2HCl = BaCl2+H2O+CO2
BaCO3+2H+2Cl = Ba+2Cl+H2O+CO2
BaCO3+2H = Ba+H2O+CO2
4) Na2CO3+KCl = NaCl+K2CO3
Здесь все вещества растворяются
5)2Fe(OH)3(осадок+3H2SO4 = Fe2(SO4)3+6H2O
2Fe(OH)3+6H+3SO4 = 2Fe+3SO4+6H2O
Fe(OH)3+3H = Fe+3H2O(снова сокращение
6) BaSO4(осадок+2HNO3 = Ba(NO3)2+H2SO4
BaSO4+2H+2NO3 = Ba+2NO3+2H+SO4
BaSO4 = Ba+SO4
7) Na2SO4+Pb(NO3)2 = 2NaNO3+PbSO4(осадок
2Na+SO4+Pb+2NO3 = 2Na+2NO3+PbSO4
SO4+Pb = PbSO4
Всё!
С какими из солей будет взаимодействовать азотная кислота: BaCl2, K2CO3, Rb2SiO3, PbSO4, Na3PO4? ПРИВЕДИТЕ УРАВНЕНИЯ ВОЗМОЖНЫХ РЕАКЦИЙ В МОЛЕКУЛЯРНОМ И ИОННОМ ВИДЕ.
2HNO3 + K2CO3 = 2KNO3 + CO2 + H2O
2H(+) + 2NO3(-) + 2K(+) + CO3(-2) = 2K(+) + 2NO3(-) + CO2 + H2O
2H(+) + CO3(-2) = CO2 + H2O
2HNO3 + Rb2SiO3 = H2SiO3 + 2RbNO3
2H(+) + 2NO3(-) + 2Rb(+) + SiO3(-2) = H2SiO3 + 2Rb(+) + 2NO3(-)
2H(+) + SiO3(-2) = H2SiO3
2HNO3 + PbSO4 = Pb(NO3)2 + H2SO4
2H(+) + 2NO3(-) + PbSO4 = Pb(+2) + 2NO3(-) + 2H(+) + SO4(-2)
PbSO4 = Pb(+2) + SO4(-2)
Составить уравнения реакций в молекулярном и ионном виде:
1.BaS+Sn(NO3)2 ->
2.Cu+SO4+K+OH ->
3.K2CO3+HCL+FeBr3+K2S ->