Напишите уравнение реакций хлора со следующими веществами: кальций, железо, водород, бромид калия. Рассмотрите приведённых вами уравнения с окислительно-восстановительной точки зрения.
Са+Cl2 = CaCl2
Ca⁰-2e = Ca⁺²-восстановитель
Cl2⁰+2e = 2Cl⁻ -окислитель
2Fe+3Cl2 = 2FeCl3
Cl2⁰+2e = 2Cl⁻-окислитель
Fe⁰-3e = Fe⁺³-восстановитель
H2+Cl2 = 2HCl
Cl2⁰+2e = 2Cl⁻-окислитель
H2⁰-2e = 2H⁺-восстановитель
2KBr+Cl2 = 2KCl+Br2
Cl2⁰+2e = 2Cl⁻-окислитель
2Br⁻-2e = Br2⁰-восстановитель
Как получить металл из WO3? Напишите уравнение реакций.
Разберите их с точки зрения окисления-восстановлеения
Для восстановления тяжелых металлов из их оксидов, обычно используется водород.
WO3+3H2 = W+3H2O
Водород проявляет в данном случае восстановительные свойства.
H2(0) -2e 2H(+) •3
W(+6)+6e W(0) •1
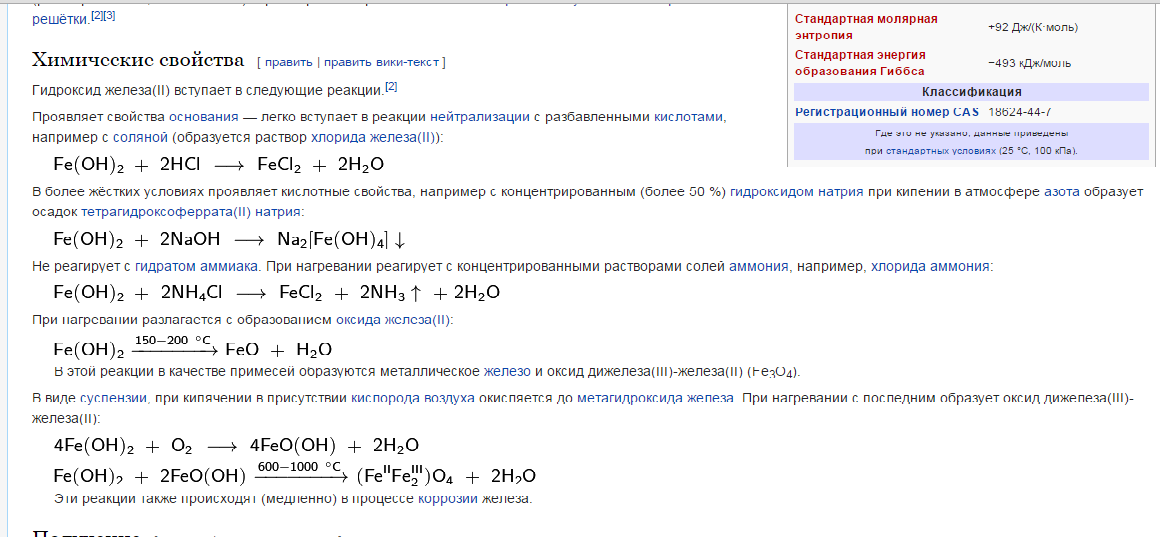
К какому классу соединений относиться Fe(OH)2. Напишите уравнение реакций, характеризующие его свойства.
Класс - основание нерастворимое
Проявляет свойства основания — легко вступает в реакции нейтрализации с разбавленными кислотами, например с соляной (образуется раствор хлорида железа(II)):
В более жёстких условиях проявляет кислотные свойства, например с концентрированным (более 50 %) гидроксидом натрия при кипении в атмосфере азота образует осадок тетрагидроксоферрата(II) натрия:
Не реагирует с гидратом аммиака. При нагревании реагирует с концентрированными растворами солей аммония, например, хлорида аммония:
При нагревании разлагается с образованием оксида железа(II):
В этой реакции в качестве примесей образуются металлическое железо и оксид дижелеза(III)-железа(II) (Fe3O4).
В виде суспензии, при кипячении в присутствии кислорода воздуха окисляется до метагидроксида железа. При нагревании с последним образует оксид дижелеза(III)-железа(II):
Эти реакции также происходят (медленно в процессе коррозии железа.
Напишите уравнение реакций, которые доказывают: а) NH4Cl содержит ионы NH4 и Cl б) (NH4)2SO4 содержит ионы NH4 и SO42-
Используем качественные реакции на катионы и анионы.
чтобы определить ион аммония: NH4+ + ОН- NH3+ Н20 выделяется газ с характерным резким запахом
чтобы определить ион хлора: Аg+ +CI- AgCl выпадает белый хлопьевидный осадок
чтобы определить сульфат-ион:
Ва2+ + S042- BaS04 выпадает белый осадок, нерастворимый в кислотах
Напишите уравнение реакций, позволяющие осущиствить следуйщие реации:
AI = AI2O3=FI2(SO4)3 = FI(OH)3 = AICI3
Не забудьте указать, что выпадает в осадок, посмотрите по таблице растворимости, если это необходимо.
$$ 4Al+ 3O_{2} = 2Al_{2}O_{3} Al_{2}O_{3}+ 3H_{2}SO_{4}=\\= Al_{2}( SO_{4}) _{3}+3H_{2}O Al_{2}( SO_{4}) _{3} + 6KOH =\\= 2Al(OH)_{3}+3K_{2}SO_{4} Al(OH)_{3}+3HCl = AlCl_{3}+3H_{2}O $$
В пронумерованных пробирках находятся растворы веществ: хлорид натрия, сульфат натрия, соляная кислота и карбонат натрия. Опытным путем определите растворв в пробирках. Напишите уравнение реакций.
1) NaCl + AgNO₃ ⇒ AgCl↓ + NaNO₃ Хлорид серебра выпадает в белый творожистый осадок
2) HCl + лакмус ⇒раствор станет красным
3) Na₂SO₄ + BaCl₂ ⇒ BaSO₄↓ + 2NaCl сульфат бария выпадет в белый осадок
4) Na₂CO₃ + CaCl₂ ⇒ NaCl + CaCO³↓ карбонат кальция выпадет в осадок
