Ковалентная химическая связь - связь, образованная направленными валентными электронными облаками. Нейтральные атомы размещены в узлах кристаллической решётки.
Ковалентная связь (от лат. co — «совместно» и vales — «имеющий силу») — химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой.
Ковалентная связь образуется за счет образования общей электронной пары у неметаллов
1) Неполярная - два неметалла с одинаковым зарядом электроотрицательности. Примеры: O2, N2, Cl2
2) Полярная - два неметалла с разными значениями электроотрицательности. Примеры: HCl, H2O, NH3
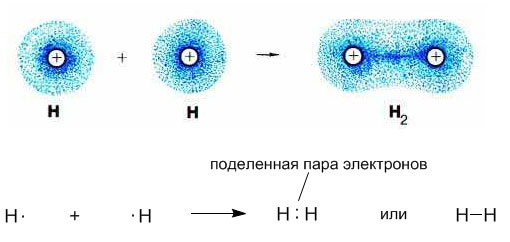
Ковалентная химическая связь возникает между:
- Двумя неметаллами одинаковой природы (O2, H2, N2)
- Двумя разными неметаллами (HF, HCl, CO, HI)
- Металлом и неметаллом (исключая случаи ионной связи)
В слове "ковалентная" приставка "ко-" означает "совместное участие". А "валента" в переводе на русский – сила, способность. В данном случае имеется в виду способность атомов связываться с другими атомами. При образовании ковалентной связи атомы объединяют свои электроны как бы в общую "копилку" – молекулярную орбиталь, которая формируется из атомных оболочек отдельных атомов. Эта новая оболочка содержит по возможности завершенное число электронов и заменяет атомам их собственные незавершенные атомные оболочки.
Рассмотрим возникновение ковалентной связи на примере образования молекулы водорода из двух атомов водорода. Этот процесс уже является типичной химической реакцией, потому что из одного вещества (атомарного водорода) образуется другое – молекулярный водород. Внешним признаком энергетической выгодности этого процесса является выделение большого количества теплоты.
Можно взглянуть на связывание двух атомов хлора 17Cl (заряд ядра Z = 17) в двухатомную молекулу с позиций строения электронных оболочек хлора. Для этого запишем формулу Льюиса для атома хлора и конфигурацию его внешней электронной оболочки На внешнем электронном уровне хлора содержится s2 + p5 = 7 электронов. Поскольку электроны нижних уровней не принимают участия в химическом взаимодействии, точками мы обозначили только электроны внешнего, третьего уровня. Эти внешние электроны (7 штук) можно расположить в виде трех электронных пар и одного неспаренного электрона. После объединения атомов в молекулу из двух неспаренных электронов атомов получается новая электронная пара.
Выберите формулы веществ, в молекулах которых ковалентная связь полярна: H2O, SCL2, BR2, PF3, P4, NF3, NH3, CL2, SIH4 и укажите на каком атоме возникает частичный положительный, а на каком частичный отрицательный заряд
Полярная в в-вах: H2O, SCl2, PF3, NF3, NH3, SiH4
Частично отрицательные заряды на атомах (соответственно формулам): O, Cl, F, F, N, Si
Частично положительные заряды на атомах (соответственно формулам):
H (на обоих атомах), S, P, H (на трёх атомах), H (на четырёх атомах).
Как образуется ковалентная связь?
Ковалентная химическая связь образуется путём создания общих электронных пар между химическими элементами-неметаллами. Она подразделяется на два типа: ковалентная полярная и ковалентная неполярная.
Ковалентная полярная связь образуется между разными элементами-неметаллами, к примеру, между хлором и кислородом.
Ковалентная неполярная связь образуется между одними и теми же химическими элементами-неметаллами, хлор с хлором, к примеру.
В ковалентной полярной связи от каждого из двух взаимодействующих элементов берётся по одному, двум или трём электронам, при этом образуется электронная пара, которая смещается в сторону более электроотрицательного элемента. Возможен донорно - акцепторный механизм связи, где один элемент создает электронную пару за счёт своих электронов, а другой элемент присоединяется к этой паре, например NH4+, у него один водород присоединён по донорно - акцепторному механимзу.
Как ковалентная связь переходит в ионную?
Ионная - крайний случай ковалентной полярной связи, когда электрон практически полностью переходит от атома с меньшей электроотрицательностью к атому с большей электроотрицательностью.
Ковалентная связь не образуется между атомами химических элементов:
1. Фосфор и Сера
2. Углерод и водород
3. Сера и водород
4. Фтор и литий
4. Фтор и литий, это ионная связь, т.е. между элементами большая разница в электроотрицательности, проще говоря ионная связь образуется между металлом и неметаллом.
В какой из молекул Ковалентная связь более поля она и почему?
А) HF или NI
Б) NH3 или H2O?
В а) ковалентная связь сильнее в HF, а в б) - сильне в H2O. В первом случае потому, что фтор более электроотрицательный, чем йод, а во втором - кислород более электроотрицательный, чем азот, соответсвенно оба эти элемента сильнее тянут на себя электронную плотность.
Что собой представляет Ковалентная связь?
Существует таблица электроотрицательности, в которой приведена электроотрицательность элементов таблицы Менделеева.
Ковалентная - значит равноценная. Связь между двумя неметаллами за счет образования пар электронов, состоящих из неспаренных электронов вступающих в связь элементов. Это обменный механизм ковалентной связи. Еще к. с. может образовываться по донорно-акцепторному механизму, за счет неподеленной электронной пары одного элемента и свободной орбитали другого. Может быть неполярная, когда электроотрицательности одинаковы или близки по значению и полярная, когда Э. О. элементов сильно различаются.
Чем подобна и чем отличается полярная ковалентная связь от неполярной?
Полярная связь - связь, при которой общая электронная пара (пары), электронная плотность смещается в сторону одного из атомов. При неполярной плотность равномерно распределена между обоими атомами. Поляризация возникает в следствии различия электроотрицательностей элементов в паре (если это двухатомная молекула), либо в молекуле (например в молекуле уксусной кислоты связь между атомами углерода поляризована), плотность смещена в сторону атома углерода, соединенного с кислородом.
В молекуле Хлора, т.е. Cl2 связь ковалентная неполярная, так как электронная плотность распределена равномерно, ни один атом молекулы не оттягивает ее на себя, потому что они однородны.
Поясните образование ковалентной связи на примере молекул водорода и бромоводорода.
Если одинаковые атомы неметаллов, то образуется ковалентная неполярная связь, например Н2. Если электрон внешнего уровня обозначить *, то Н* + *Н = Н**Н
HBr: молекула образована разными атомами неметаллов, поэтому связь будет ковалентной полярной. У атома брома на внешнем уровне находятся 7 электронов, до завершения уровня не хватает 1 электрона. Этот электрон предоставляет атом Н*. Когда они объединились, уровень стал завершённым, но при этом электронная плотность будет смещена в сторону более электроотрицательного атома брома, связь становиться полярной.
Неполярная ковалентная связь имеется в молекуле: 1) HCL 2) NACL 3) SIF4 4) O2
O2, так как оба ядра равны по размерам и электроотрицательности.
Как ведет себя полярная ковалентная связь хлороводорода при растворении в воде?
Диссоциация веществ с ковалентной полярной связью происходит несколько сложнее, например диссоциация хлороводорода в воде. Сначала происходит взаимодействие молекул воды с молекулами НСl, находящимися в узлах кристаллической решетки, и их отщепление от нее, а затем происходит «растягивание» полярной молекулы НСl на гидратированные ионы. Уравнение электролитической диссоциации хлороводорода выглядит так:
Только ковалентная связь имеет место в соединении с формулой: 1) Ba (OH)2 2) NH4NO3 3) H2SO4 4) Li 2CO3.
Это серная кислота. Только она в данном ряду имеет ковалентную полярную связь, т.к. формула состоит из элементов-неметаллов с разной электроотрицательностью.
Как узнать, какая ковалентная связь в органическом соединении? Она бывает одинарная, двойная и тройная.
Вообще каждому классу органических соединений соответствует своя связь, например в алкенах, помимо одинарных связей, существует одна двойная, в алкинах существет одна тройная связь. Всё зависит от класса к которому принадлежит соединение.
1. В каких молекулах ковалентная связь образована перекрыванием только р-орбиталей обоих атомов: H2, HF, HCl, F2, I, HBr?
2. Какое число связывающих и какое число неподелённых электронных пар имеется в каждой из молекул: H2O, Cl2, HF, Br2, ClF?
3. В молекулах каких из указанных веществ ковалентные связи являются полярными, а каких - неполярными: H2O, HCI, CI2, CH4, N2, H2, N2, CO2, NF?
1.F2
2. H2O (связывающих пар одна, простая связь Н-О-Н), Cl2 (связывающих пар одна, простая связь, за счет 2 электронов), HF(связывающих пар одна Н-F), Br2 (связывающих пар одна, за счет 2 электронов), Cl F(связывающих пар одна, за счет 2 электронов)
3. H2O - водородная связь, ковалентно полярная; HCl - ковалентно полярная; Cl2 - ковалентно неполярная; CH4 - ковалентно полярная; N2 - ковалентно неполярная; H2 - ковалентно неполярная; N2 - ковалентно неполярная; CO2- ковалентно полярная; NF - ковалентно полярная.