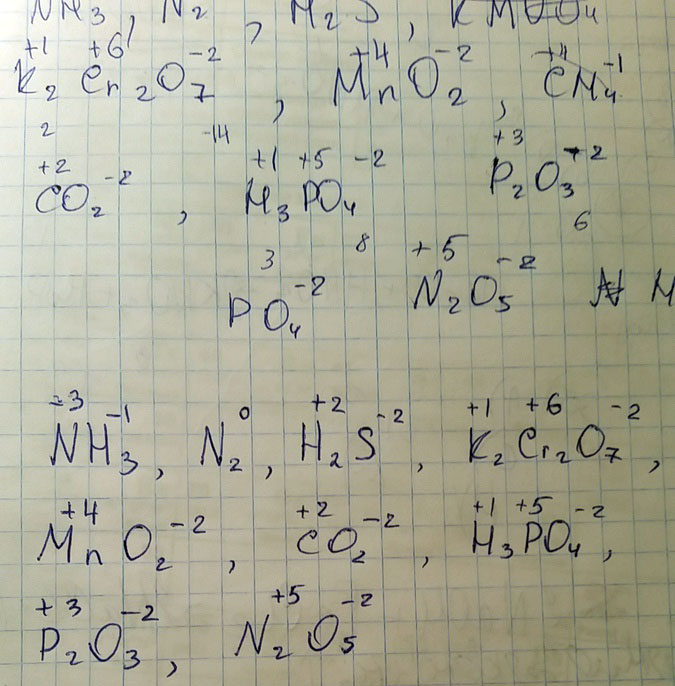Чему равен высшая степень окисления элементов 3-его периода
В зависимости от номера группы, в которой находится элементNa +1
Mg +2
Al +3
Si +4
P +5
S +6
Cl +7
Ar 0, так как инертный газ, электронная оболочка максимально заполнена, 8 валентных электронов.
1. Определите степень окисления элементов по формуле:
SI6
2. Составьте формулу в-ва по степеням окисления:
Ba N Al CL Fe3+ S K I
3. Рассчитайте массовую долю калия в K3PO4.
1.
S⁺⁶I₆⁻
2.
Ba₃⁺²N₂⁻³
Ba⁺²Cl₂⁻
Ba⁺²S⁻²
Ba⁺²I₂⁻
Al⁺³N⁻³
K₃⁺N⁻³
N⁺³Cl₃⁻
N⁺³I₃⁻
Ba⁰; N₂⁰; Al⁰; Cl₂⁰
Al⁺³Cl₃⁻
Fe₂⁺³S₃⁻²
K⁺I⁻
3.
M(K3PO4)=212 г/моль
ω(К = 117 г/212 г × 100% = 55,19%
Рассчитайте массовую долю калия в K3PO4.
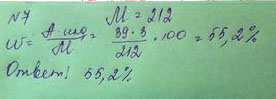
1. Выберите кислоты
А – BaCl2
Б – HAlO2
В – Cr2O3
Г - HNO3
2. Классифицируйте кислоты по основности:
H2ZnO2, HCN, H3AsO4, H4SiO5, HIO3
3. Определите валентность кислотного остатка
HClO2, H2MnO4, H4P2O7
4. Определите степень окисления элементов в кислотах:
HReO4, H6TeO6, H2SnO3
5. Закончить уравнения реакций и распишите их в полном и сокращенном ионном виде:
А HCl + AgNO3 →
Б HgCl2 + H3PO4 →
В Sr(NO3)2 + H2SO4 →
6. Установите соответствие между формулой кислоты и её молекулярной массой
1) H2CO3 A - 62
2) HIO4 Б - 34
3) H2S В - 192
7. Выбрать вещества, с которыми взаимодействует HNO3
A) H2O5
Б P
В CaCl2
Г Cu
Д LiOH
1. Б и г
2. HCN, HIO3 - одноосновные; H2ZnO2 - двухосновная; H3AsO4 - трёхосновная; H4SiO5 - четырёхосновная
3. ClO2⁻, MnO4²⁻, P2O7⁴⁻
4. HRe⁺⁷O4, H6Te⁺⁶O6, H2Sn⁺⁴O3
5. А HCl + AgNO3 → AgCl + HNO3
H⁺ + Cl⁻ + Ag⁺ + NO3⁻ → AgCl + H⁺ + NO3⁻
Cl⁻ + Ag⁺ → AgCl
Б 3HgCl2 + 2H3PO4 → Hg3(PO4)2 + 6HCl
3Hg²⁺ + 6Cl⁻ + 6H⁺ + 2PO4³⁻ → Hg3(PO4)2 + 6H⁺ + 6Cl⁻
3Hg²⁺ + 2PO4³⁻ → Hg3(PO4)2
В Sr(NO3)2 + H2SO4 → SrSO4 + 2HNO3
Sr²⁺ + 2NO3⁻ + 2H⁺ + SO4²⁻ → SrSO4 + 2H⁺ + 2NO3⁻
Sr²⁺ + SO4²⁻ → SrSO4
6. 1) A
2) В
3) Б
7. Б Г Д
полагаю в А там опечатка и предполагался оксид азота (V)
Определите степень окисления элементов следующих соединениях: О2, KI, FeCl3, NaBr, K2SO3, KMnO4.
О2 = 2- KI = K+I- Fe3+Cl3- Na+Br- K2+SO3- KMn4+O4- ТЕСТ по теме Алюминий
Вопрос 1
Самым распространенным в земной коре металлом является:
Na
Ca
Al
Fe
Вопрос 2
Самым активным металлом среди перечисленных является:
Na
Al
K
Mg
Вопрос 3
Какова электронная конфигурация атома алюминия:
1s22s2p3
1s22s2p1
1s22s2p6; 3s2p1
1s22s2p6; 3s2p6 3 d10 4s2
Вопрос 4
С какими из указанных веществ не реагирует алюминий ( с оксидной плёнокой
O2
NaCl
NaOH
H2O
Вопрос 5
Какой из указанных металлов является более активным, чем алюминий;
Na
Zn
Fe
Cu
Вопрос 6
Алюминий взаимодействует со всеми веществами группы
НСl, Н 2О, Н2, SO3
О2, N2, Н 2О, Cu
О2, НСl, S, Н2О
КОН, Н2, О2, НNO3
Вопрос 7
Для алюминия характерны свойства
окислителя
восстановителя
окислителя и восстановителя
Вопрос 8
Выберите физические свойства, характерные для алюминия
лёгкий, электропроводный, серебристо-белый.
тяжёлый, тугоплавкий, электропроводный
легкоплавкий, твёрдый, полупроводник
пластичный, токсичный, теплопроводный
Вопрос 9
Амфoтерные соединения образует
Ca
Al
Na
Li
Вопрос 10
В самородном состоянии встречается в природе:
Al
Na
Cu
Mg
Вопрос 11
Алюминий входит в состав следующего природного соединения
сильвинит
гипс
кальцит
корунд
Вопрос 12
В ряду Na – Мg – Аl – Si:
увеличивается число энергетических уровней в атомах;
усиливаются металлические свойства элементов;
уменьшается высшая степень окисления элементов
ослабевают металлические свойства элементов
Вопрос 13
Сплав на основе алюминия называется:
бронза
мельхиор;
латунь
дюралюминий
1. Железо
2. Калий
3.2
4. Хлорил натрия, гидроксид натрия
5. Натрий
6.3
7. Восстановителя
8.1
9. Аллюминий
10. Медь скорее всего, потому что более неактивный металл.
11. Сильвинит
12.1.4
13. Дюраллюминий
Определите степень окисления элементов в соединениях и дать названия веществам: 1) Zn3P2. 2) Mn2O3. 3) AlBr3. 4) Na4C. 5) Ca2Si. 6) N2O.
1) фосфид цинка Zn (+2) P(-3)
2) Оксид марганца (III) Mn (+3) O (-2)
3) Бромид алюминия Al (+3) Br (-1)
4) Карбид натрия Na (+1) C (-4)
5) Силицид кальция Ca (+2) Si (-4)
6) Оксид азота (I) N (+1) O (-2)
1. Определить степень окисления элементов в следующих соединениях: SO2, H2SO4, FeCl2, KClO3, NH3, P2O5.
2. Расставьте коэффициенты в окислительно – восстановительной реакции, составьте схему электронного баланса:
А KClO3 + P → P2O5 + KCl.
Б Fe2O3 + H2 → Fe + H2O
3. Вычислить массовую долю растворенного вещества, если в 68 г воды растворили 12 г соли.
4. Сколько молей водорода необходимо для реакции с оксидом меди массой 4 грамма?
5. Записать уравнения реакций горения сложных веществ, расставить коэффициенты:
А C2H4
Б C3H8
1) SO2 - S+4, O -2; H2SO4 - H+1, S+6, O-2; FeCl2 - Fe+2, Cl-1;KClO3 - K+1, Cl+5, O-2;NH3 - N-3, H+1;P2O5- P+5, O-2
4) CuO+H2 = Cu + H2O
m(H2)-x
x = (4*2)/80= 0, 1 г
n = m/M
M(H2) = 2
n = 0, 1/2 = 0, 05 моль
5) C2H4 + 3O2 = 2CO2 + 2H2O
C3H8 + 5O2 = 3CO2 + 4H2O
Определите степень окисления элементов и тип хим. связи в соединениях: H2S, CaO, N2, K3N
Назовите все вещества
H+1, S-2,CA +2,O-2, N2 = 0, K+1, N-3,
H2⁺S⁻² сероводород, ковалентная полярная связь
Ca⁺²O⁻² оксид кальция, ионная связь
N2⁰ азот, ковалентная неполярная
K3N нитрид калия, ионная
Надо определить степень окисления элементов: NH3, N2, H2S, KMUO4, K2Cr2O7, MnO2, CH4, CO2, H3PO4, P2O3, N2O5, H2H4,(NH4)3, PO4.