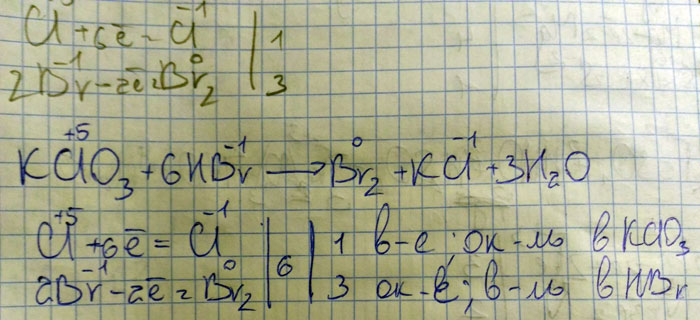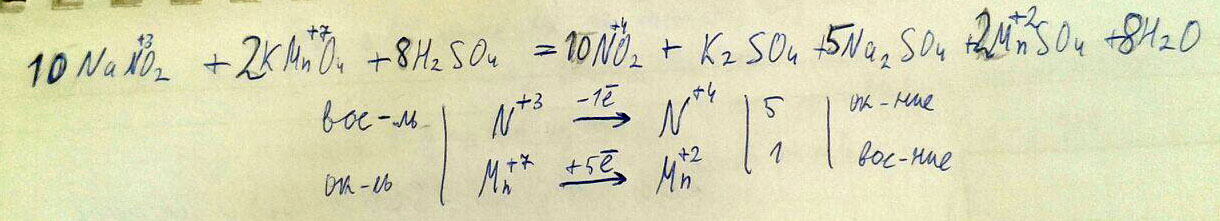Метод электронного баланса - задачи и примеры
Используя метод электронного баланса, расставьте коэффициенты в уравнение реакции, схема которой Zn+H2So4 = H2S+ZnSo4+H2o
Определите окислитель и восстановитель
Решая методом полуреаций, у меня получается:
4H2SO4 (конц. ) + 4Zn = 4ZnSO4 + H2S + 4H2O
-
SO4 + 8H +8е -> S + 4H2O
Zn(0) - 2e -> Zn(2+)
SO4+8H+4Zn -> S+4H2O+4Zn
на сайте химик. Ру это реакция написана так:
5H2SO4 (конц. ) + 4Zn = 4ZnSO4 + H2S + 4H2O
на получай
Восстановитель Zn[0] =Zn[+2] Окислитель S[+6]=S[-2] 4Zn+5H2So4 = H2S+4ZnSo4+4H2O
Использовать метод электронного баланса составить уравнение реакции
K2S + HCLO3 + H2OF = KCL+ SO + KOH
K2S + HCLO3 + H2O = KCL+ SO + KOH
степени окисления(K-+1 S-2;H-+1 CL-+5 O-2;H-+1 O-2;=K-+1 CL-1;S-+2 O-2;K-+1 O-2 H-+1)
CL(+5)+6e = CL(-1)
S(-2)-4e = S(+2)
=>3K2S + 2HCLO3 + 3H2O = 2KCL+ 3SO + 6KOH
K2S(S-2)-Восстановитель
HCLO3(Сl+5)-Окислитель
Составьте уравнение химической реакции используя метод электронного баланса KClO3+.=Br2+KCl2+.
Ручкой написано. Межмоллекулярная реакция, если что. И перед Br2 надо коэффициент 3 поставить (3Br2)
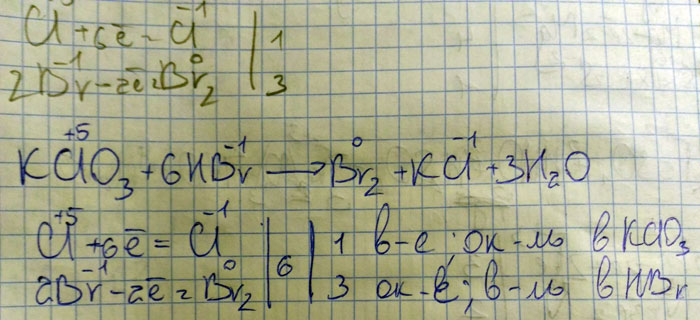
Используя метод электронного баланса составьте уравнение реакции: KNO2+KI+H2SO4-I2+NO+K2SO4+HBO ОПРЕДЕЛИТЕ ОКИЧЛИТЕЛЬ И ВОСТОНОВИТЕЛЬ
Это решение уравнения. И кажется что там не НВО, а Н2О

20. Используя метод электронного баланса, составьте уравнение реакции
CuO + NH3 → Cu + N2 + H2O.
Определите окислитель и восстановитель.
21. При взаимодействии алюминия с соляной кислотой получили 6,72 л (н.у.) водорода и 178 г раствора соли. Вычислите массовую долю соли в полученном растворе.
22. Для проведения эксперимента предложены следующие реактивы: AgNO3, MgSO4, MgCl2, Na2CO3 и растворы HNO3, HCl. Используя воду и необходимые вещества только из этого списка, получите в две стадии хлорид магния. Опишите признаки проводимых реакций. Для второй реакции напишите сокращённое ионное уравнение.
20. 3CuO+2NH3 = 3Cu+N2+3H2O
Cu⁺²+2e = Cu⁰ 2 3 окислитель
2 N⁻³- 6e = N2⁰ 6 1 восстановитель
21.
xg 6.72L
2Al+6HCl = 2AlCl3+3H2↑
267g 67.2L
x = 267·6.72/67.2 = 26.7g
w = 26.7/178·100%=15%
22.
MgSO4+Na2CO3⇒MgCO3↓+Na2SO4
MgCO3+2HCl = MgCl2+H2O+CO2↑
Объясните, что такое "Метод электронного баланса"?
Если ты умеешь определять степени окисления в веществах( МЭБ- это метод, который применяется в расстановке коэффициентов в уравнениях реакций. Обычно используется в том случае, если не получается расставить коэфы в уравнении. Например, получение воды:
H2 + O2 = H2O. Коэф-ы расставить будет нетрудно:
2H2 + O2= 2H2O.
Используя метод электронного баланса, составьте уравнение окислительно- восстановительной реакции:
KNO2 + K2Cr2O7 + H2SO4 → KNO3 + Cr2(SO4)3 +K2SO4 +H2O
Укажите окислитель и восстановитель.
KNO₂ + K₂Cr₂O₇ + H₂SO₄ → KNO₃ + Cr₂(SO₄)₃ + K₂SO₄ + H₂O
Уравнения баланса:
N⁺³ - 2e = N⁺⁵ | |*3 (реакция окисления, восстановитель - KNO₂)
|6 |
Cr⁺⁶ + 3e = Cr⁺³ | |*2 (реакция восстановления, окислитель - K₂Cr₂O₇)
Суммарное уравнение баланса: 3N⁺³ + 2Cr⁺⁶ = 3N⁺⁵ + 2Cr⁺³
3KNO₂ + K₂Cr₂O₇ + 4H₂SO₄ → 3KNO₃ + Cr₂(SO₄)₃ +K₂SO₄ + 4H₂O
Используя метод электронного баланса поставить коэффициенты и определить окислитель и восстановитель. Куда именно и как нужно ставить коэффициенты после электронного баланса в уравнении?
Допустим, что у нас есть одно уравнение:
Ag + HNO₃ → AgNO₃ + NO + H₂O, и нам нужно расставить коэффициенты методом электронного баланса.
Шаг первый.
Над каждым элементом обозначим степень его окисления.
Ag⁰ + H⁺ N⁺⁵ O⁻²₃ → Ag⁺ N⁺⁵ O⁻²₃ + N⁺² O⁻² + H⁺₂O⁻²
Шаг второй.
Составляем электронный баланс.
Ag⁰ - 1e = Ag⁺ (коэффициент 3)
N⁺⁵ + 3e = N⁺² (коэффициент 1)
Серебро (Ag) теряет один электрон, азот приобретает три. Таким образом, мы видим, что для балансировки нужно применить коэффициент 3 для серебра и 1 для азота. Тогда число теряемых и приобретаемых электронов сравняется.
Шаг третий.
Теперь на основании полученного коэффициента "3" для серебра, начинаем балансировать все уравнение с учетом количества атомов, участвующих в химической реакции.
а В первоначальном уравнении перед Ag ставим тройку, что потребует такого же коэффициента перед AgNO₃:
3Ag + HNO₃ → 3AgNO₃ + NO + H₂O
б Теперь у нас возник дисбаланс по количеству атомов азота. В правой части их четыре, в левой - один. Поэтому ставим перед HNO₃ коэффициент 4.
3Ag + 4HNO₃ → 3AgNO₃ + NO + H₂O
в Теперь остается уравнять 4 атома водорода слева и два - справа. Решаем это путем применения коэффициента 2 перед H₂O, и получаем, что справа и слева одинаково коэффициентов водорода.
г Проверим также и кислород. В левой части написано 3, но мы умножаем на число, которое стоит перед формулой вещества, это число 4. Получаем 12. В правой части 9, 1, 2. Итого 12.
Ответ:
3Ag + 4HNO₃ → 3AgNO₃ + NO + 2H₂O
Используя метод электронного баланса составьте уравнение реакции NaNO2+KMnO4+ H2SO4 = NO2+K2SO4+Na2SO4+MnSO4+H2O
определите окислитель и восстановитель
Решение во вложении:
Извините за качество фото
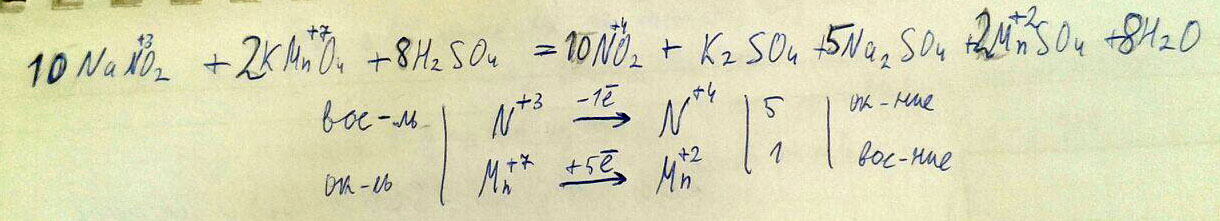
KIO3+HI = I2+KI+H2O
используя метод электронного баланса, расставьте коэффиценты и определите окислитель и восстановитель
1. вложения, я расставила степени окисления (с. О. )
У простых веществ всегда с. О. = 0
У кислорода всегда = - 2
В сумме степени окисления = 0 ( считала у первого, голубым обозначила то, что считала
Остальные я смотрела по таблицам в учебнике.
2. Коричневым и салатовым подчеркнула элементы, которые поменяли с. О. (ведь ОВР - изменение с. О
3. Восстановитель повышает с. О ( процесс окисление
Окислитель понижает с. О. (процесс восстановление
Посчитала и сократила, подставила в формулу. В целом это все ( если что у простого вещества йод всегда двойка, поэтому я у восстановителя подписала ее
Окислитель: 2l(5+)+10e = l2(0)
восстановитель:2l(-)-2e = l2(0)
kio3+6hi = 3i2+ki+3h20