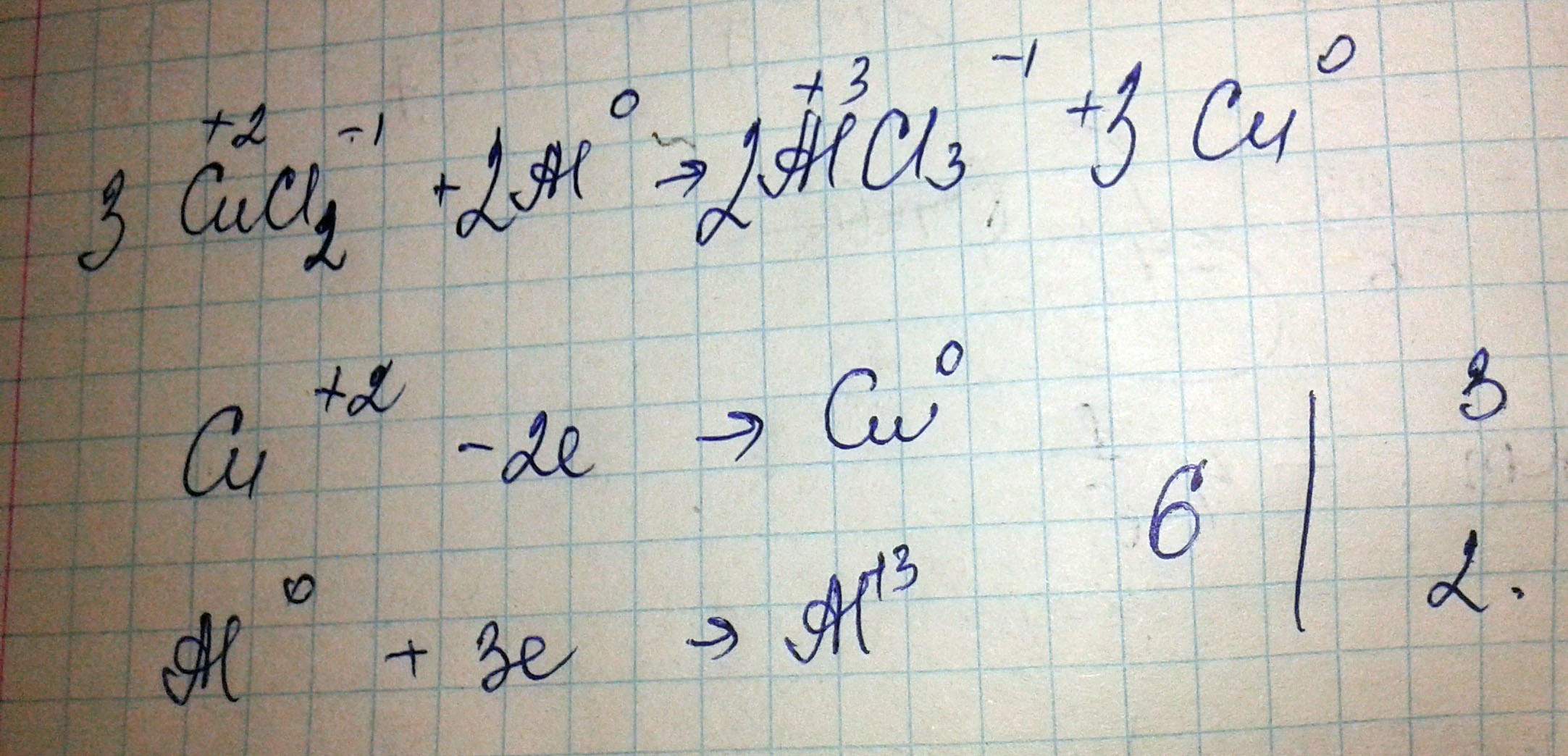Расставить коэффициенты методом электронного баланса - задачи и примеры
Раставьте коэффициенты методом электронного баланса, укажите окислитель и востоновитель
КNO3+Pb- KNO2+PbO
2) PCL +PH3-P+HCL
KNO3 + Pb -> KNO2 + PbO
N(+5) +2e -> N(+3) 1 ок-ль, в-ие
Pb(0) -2e -> Pb(+2) 1 в-ль, ок-ие
3PCl + PH3 -> 4P + 3HCl
P(+) +1e -> P(0) 3 ок-ль, в-ие
P(-3) -3e -> P(0) 1 в-ль, ок-ие
Расставьте коэффициенты методом электронного баланса:
1.NH4CL+H2SO4=(NH4)2SO4+HCL
2.MgCL+H2O = Mg(OH) CL+HCL
3.Cr2S3+H2O = H2S+Cr(OH)3
4.Pb(NO3)2 = PbO+NO2+O2
1) 2NH4Cl + H2SO4 = (NH4)2SO4 +2HCl (это не ОВР, а ионный обмен
2NH4(+) + 2Cl(-) + 2H(+) + SO4(-2) = 2NH4(+) + SO4(-2) + 2H(+) + 2Cl(-)
реакция не идёт
2) MgCl2 + H2O = Mg(OH) Cl + HCl ( это не ОВР, а ионный обмен
Mg(+2) + 2Cl(-) + H2O = MgOH(+) + Cl(-) + H(+) + Cl(-)
Mg(+2) + H2O = MgOH (+) + H(+)
3) Cr2S3 + H2O = H2S + Cr(OH)3 ( это не ОВР, а ионный обмен
Сr2S3 - в растворе не существует
4) 2Pb(NO3)2 -> 2PbO + 4NO2 + O2
N(+5) +1e = N(+4) 4 ок-ль, в-ие
O(-2) -2e = O(0) 2 в-ль, ок-ие
Расставьте коэффициенты методом электронного баланса и укажите окислитель и восстановитель в схемах реакций.
Ca(металл -
1)+О2
2)+S
3)+Cl2
4)+H2
5)+N2
6)+C
______________
.
2Сa + O2 = 2CaO
Ca(0)-2e = Ca(+2) 2 в-ль, ок-ие
O2(0) +4e = 2O(-2) 1 ок-ль, в-ие
Сa + S = CaS
Ca(0) -2e = Ca(+2) 1 в-ль, ок-ие
S(0) +2e = S(-2) 1 ок-ль, в-ие
Сa + Cl2 = CaCl2
Ca(0)-2e = Ca(+2) 1 в-ль, ок-ие
Cl2(0) +2e = 2Cl(-) 1 ок-ль, в-ие
Ca + H2 = CaH2
Ca(0)-2e = Ca(+2) 1 в-ль, ок-ие
H2(0) +2e = 2H(+) 1 ок-ль, в-ие
3Ca + N2 = Ca3N2
Ca(0)-2e = Ca(+2) 3 в-ль, ок-ие
N2(0) +6e = 2N(-3) 1 ок-ль, в-ие
2Ca + C = Ca2C
Ca(0) -2e = Ca(+2) 2 в-ль, ок-ие
C(0) +4e = C(-4) 1 ок-ль, в-ие
CuCl2+Al ->AlCl3+Cu расставьте коэффициенты методом электронного баланса (с окислителем и восстановителем).
3СuCl2+2Al = 2AlCl3+3Cu
1. На обратной стороне таблицы Менделеева записаны ионы (например: Н+,Li+ и т. д., по данной реакции нужно определить и написать над хим. элементом где +; 2+; 3+. 2. У элементов одиночек всегда будет 0 ( например как в нашем случае Al и Cu). 3. Мы должны уровнять ионы в левой и правой частях( в нашем случае Cu^+2 - 2e-> Cu^0 ), так же и с Al. Затем находим НОК электронов ( у нас это 6). Этот НОК делим на каждое число электрона( Cu : 6:2 = 3; Al : 6:3 = 2). Теперь полученные значения подставляем перед нужным элементом в реакции и проверяем.
Cucl2+al = alcl3+cu
cu степень окисления +2, у хлора -1
алюминий 0 (до
alcl3(al+3. cl-), cu 0
cu+2е-=сu0 -3 -процесс восстановления, ок-ль
al-3e-=al+3 -2 - процесс окисления, в-ль
3cucl2+2al = 2alcl3+3cu
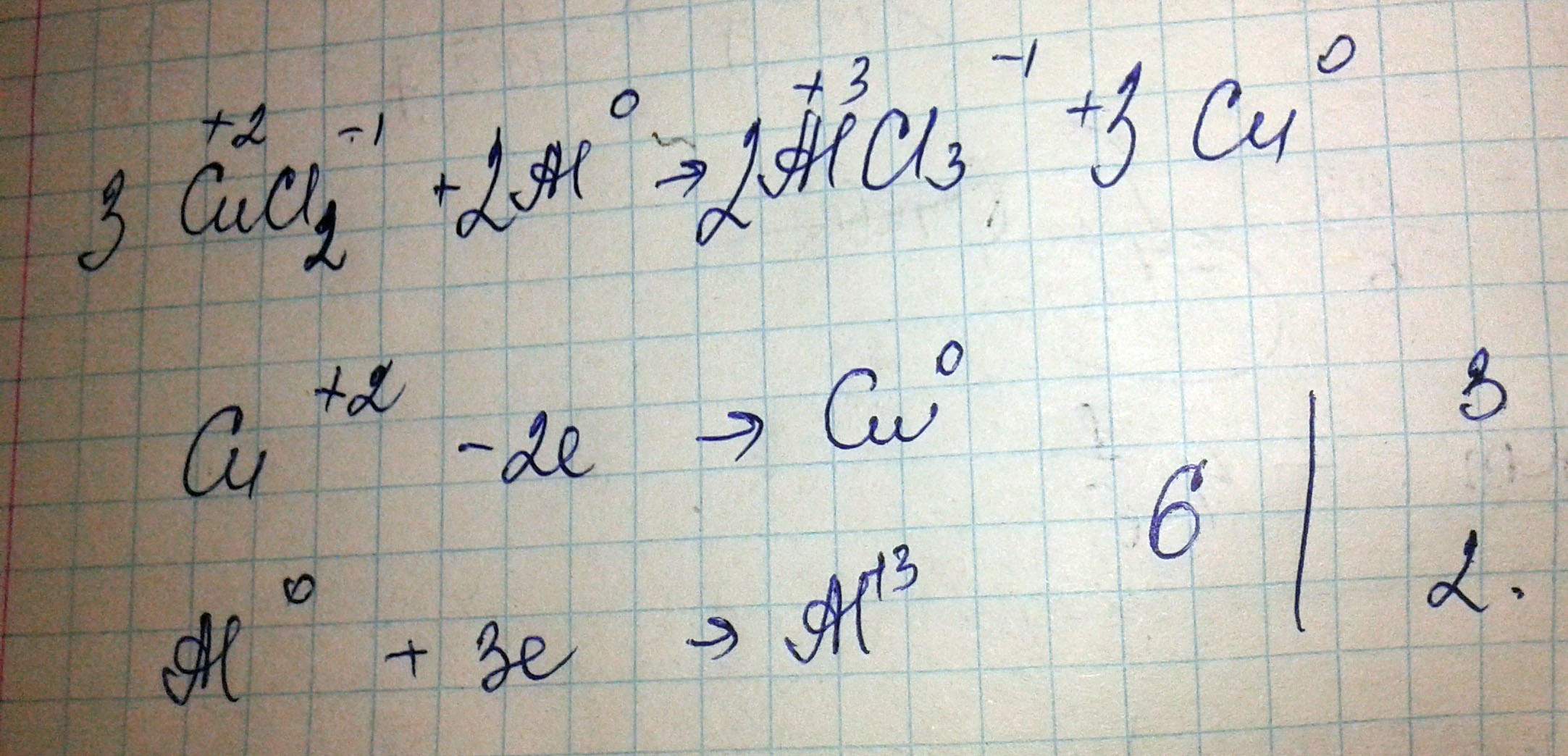
Преобразуйте данные схемы в уравнения реакций расставьте коэффициенты методом электронного баланса:
Zn + H2SO4 → ZnSO4 + H2S + H2O
В скобках указаны заряды
Zn(0) + H2S(+6) O4 -> Zn(+2) SO4 + H2S(-2) + H2О
Zn(0) - 2e = Zn(+2) восстановитель, окисление
S(+6) + 8e = S(-2) окислитель, восстановление
4Zn + 5H2SO4 -> 4ZnSO4 + H2S + 4H2О
В приведенных уравнениях реакции расставьте коэффициенты методом электронного баланса, укажите процессы окисления и восстановления, окислитель, восстановитель Al+O2 = Al2O3; H2S+O2+S+H2O; NH3+O2+NO+H2O
1) 4Al+3O2 = 2Al2O3
Al(0)-3e = Al(+3) - ок-е, восс-ль
O2(0)+4e = 2O(-2) - восс-е, ок-ль
2) 2H2S+O2 = 2S+2H2O
S(-2)-2e = S(0) - ок-е, восс-ль
O2(0)+4e = 2O(-2) - восс-е, ок-ль
3) 4NH3+5O2 = 4NO+6H2O
N(-3)-5e = N(+2) - ок-е, восс-ль
O2(0)+4e = 2O(-2) - восс-е, ок-ль
Расставьте степени окисления атомов. Расставьте коэффициенты методом электронного баланса. Укажите окислитель, восстановитель.
а) C+HNO3-> CO2+NO+H2O
б) Cu+HNO3-> Cu(NO3)2+NO+H2O
в) P2O5+C-> P+CO

Осуществите превращения:
сера-сероводород-оксид серы(2)-оксид серы(3)-сульфат натрия-сульфат бария
В уравнении реакции 4 расставьте коэффициенты методом электронного баланса.
S + H2 = H2S
H2S + O3 = SO2 + H2O
2SO2 + O2 = 2SO3
S⁺⁴ - 2e = S⁺⁶ x2
O2 + 4e = 2O⁻²
SO3 + 2NaOH = Na2SO4 + H2O
Na2SO4 + BaCl2 = BaSO4 + 2NaCl
и о каком именно уравнении шла речь? Метод электронного баланса применим к первым трём.
1. Напишите уравнения реакций взаимодействия калия с хлором, водой, серной кислотой. Расставьте коэффициенты методом электронного баланса. е

1) Закончить уравнение химических реакций записать полное и ионное уравнение реакций
2) Расставить коэффициенты методом электронного баланса
1) CaCO3(Стрелка вниз)+H2SO4 = CaSO4+H2CO3
CaCO3+2H(+)+SO4(2-)=Ca(2+)+SO4(2-)+2H(+)+CO3(2-)
CaCO3 = Ca(2+)+CO3(2-)
2)3LiCl+H3PO4 = Li3PO4(стрелка вниз)+3HCl
3Li(+)+3Cl(-)+3H(+)+PO4(3-)=Li3PO4+3H(+)+3Cl(-)
3Li+PO4(3-)=Li3PO4
3) Cr2(SO4)3+6NaOH = 2Cr(OH)3(стрелка вниз)+3Na2SO4
2Cr(3+)+3SO4(2-)+6Na(+)+6OH(-)=2Cr(OH)3+6Na(+)+3SO4(2-)
2Cr(3+)+6OH(-)=2Cr(OH)3
4) FeCl3+3HF = FeF3(стрелка вниз)+3HCl
Fe(3+)+3Cl(-)+3H(+)+3F(-)=FeF3(стрелка вниз)++3H(+)3Cl(-)
Fe(3+)+3F(-)=FeF3(стрелка вниз)
№3
1) H2 + Cl2 = 2HCl
2) Ca + 2HCl = CaCl2 + H2↑
3) CaCl2 + 2AgNO3 = 2AgCl + Ca(NO3)2