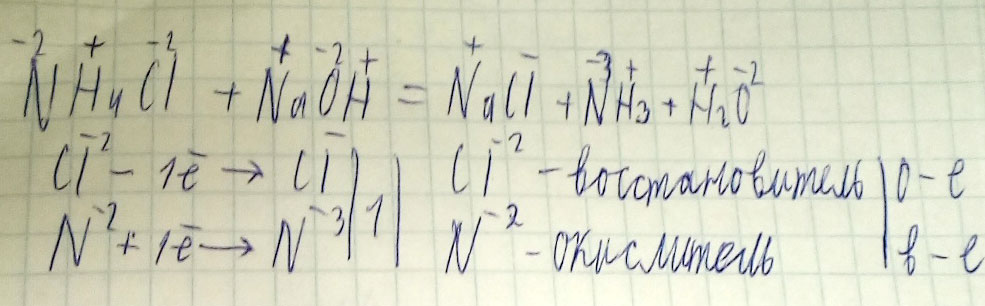Укажите окислитель и восстановитель - задачи и примеры
Составьте уравнения реакций между: а) Натрием, б) калием и водородом, в) литием и хлором. Укажите окислитель и восстановитель, реакции окисления и восстановления
2Na + H2 = 2NaH
Na-1 e = Na+ восстановитель, окисляется
H2 + 1e*2 = 2H- окислитель, восстанавливается
Калий то же самое!
2Li + CI2 = 2LiCI
баланс такой же только подставь
Составьте уравнение реакции натрия с водой. Укажите окислитель и восстановитель, реакции окисления и восстановления
2H2O+2Na = 2NaOH+H2 Восстановитель Na^0-1e = Na^+1 Окислитель 2H^+1+2e = H2^0 Подводим электронный баланс: наименьшее краткое 2, делим, получаем Na 2, H2 1, расставляем коэффициенты Восстановитель Na, за счет Na^0 Окислитель H2O, за счет H^+1
Окислительно-восстановительные реакции протекают: Mn(OH)2+Cl2+KOH =MnO2+KCl+H2O
PbS+HNO3 = S+Pb(NO3)2+NO+H2O. Для каждой реакции укажите а окислитель и восстановитель; б какое вещество окисляется, какое вещество восстанавливается. Составьте электронные уравнения и на основании их расставьте коэффициенты в уравнениях реакций.
Решить
Mn(OH)2 + Cl2 + 2KOH -> MnO2 + 2KCl + 2H2O
Mn(+2) -2e = Mn(+4) 1 в-ль, ок-ие
Cl2(0) +2e = 2Cl(-) 1 ок-ль, в-ие
3PbS + 8HNO3 = 3S + 3Pb(NO3)2 + 2NO +4 H2O
S(-2) -2e = S(0) 3 в-ль, ок-ие
N(+5) +3e = N(+2) 2 ок-ль, в-ие
Указать окислитель и восстановитель, сделать схему электронного баланса
NH4Cl+NaOH = NaCl+NH3+H2O
NH4Cl + NaOH = NaCl + NH3 + H2O (это не ОВР, а ионное уравнение
NH4(+) + Cl(-) + Na(+) + OH(-) = Na(+) + Cl(-) + NH3 + H2O
NH4(+) + OH(-) = NH3 + H2O
Держи и не благодари
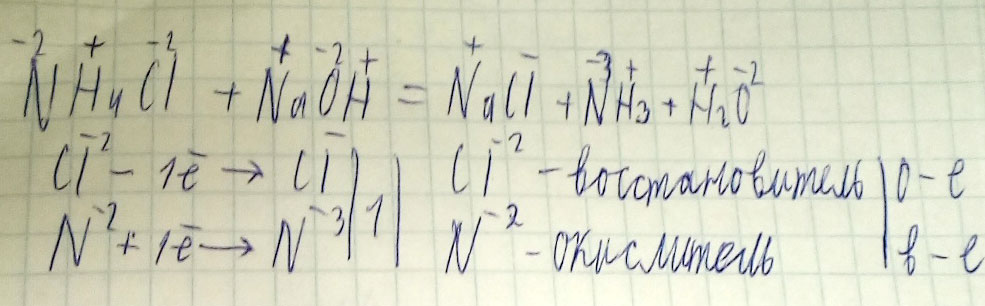
Fe+PbSO4 = FeSO4+Pb Окислительно-восстановительная реакция
Составить баланс электронов
Определить окислитель и восстановитель
железо с зарядом2- отдает 2 электрона получаетя железо с зарядом 0 (железо восстановитель
свинец с зарядом 0 принимает 2 электрона получается свинец с зарядом 2-
(свинец - окислитель
Составить уравнения реакций (окислитель и восстановитель)
HCl+KMnO4 = KCl+2MnCl2+5Cl2+H2O
16HCl+2KMnO4 = 2KCl+2MnCl2+5Cl2+8H2O; ( в квадратных скобах написаны заряды 2Cl[-] -2e =Cl2[0] | 5 | процесс окисления, 2Cl[-] - восстановитель; Mn[+7] +5e = Mn[+2] | 2 | процесс восстановления, Mn[+7] - окислитель.
Расставить коэфициенты в схемах реакций методом электронного баланса, указать окислитель и восстановитель, процессы окисления и восстановления:
1) Cl2+KOH-> KClO3+KCl+H2O
2) KNO3-> KNO2+O2
1. 3Cl₂ + 6KOH = KClO₃ + 5KCl + 3H₂O.
2Cl⁰ – 10e = 2Cl⁺⁵ | 1 — восстановитель, окислился.
2Cl⁰ + 2e = 2Cl⁻ | 5 — окислитель, восстановился.
2. 2KNO₃ = 2KNO₂ + O₂.
N⁺⁵ + 2e = N⁺³ | 6 — окислитель, восстановился.
O⁻² – 12e = 6O⁰ | 1 — восстановитель, окислился.
4. Расставить коэффеценты в схемах реакций методом электронного баланса, указать окислитель и восстановитель, процессы окисления и восстановления:
1) HNO3 + Cu → Cu(NO3)2 + NO2 +H20
2) Zn + H2SO4 → ZnS04 + S + H20
1) N(+5) + e = N(+4) 2 окислитель восст-ся
Cu(0) - 2e = Cu(+2) 1 восст-ль окисл-ся
4HNO3 + Cu = Cu(NO3)2 + 2NO2 + 2H2O
2) Zn(0) - 2e = Zn(+2) 3 восс-ль оксил-ся
S(+6) + 6e = S(0) 1 ок-ль восст-ся
3Zn + 4H2SO4 = 3ZnSO4 + S + 4H2O
1. Уравняйте схему реакций с помощью электронного баланса, укажите окислитель и восстановитель:
а HBr + H2SO4 → SO2↑ + H2O + Br2
б Al + NaOH → NaAlO2 + H2↑
2. Закончите уравнения возможных реакций, запишите их в молекулярном, полном ионном и сокращенном ионных видах:
а Ba(OH)2 + Zns →
б KOH + HNO3 →
в FeCl2 + KOH →
г K2SiO3 + BaCl2 →
д Ca(OH)2 + Na2CO3 →
3. По сокращенным ионным уравнениям реакций напишите полные ионные и молекулярные уравнения реакций ионного обмена:
а Fe3 + OH → Fe(OH)3↓
б PbS + 2H+ → H2S↑ + Pb²+
3 не совсем поняла, как делать

Закончите уравнения химических реакций и расставьте коэффициенты. Для уравнения каждой окислительно восстановительной реакции составьте схему
электронного баланса, укажите окислитель и восстановитель, процессы окисления и восстановления:
гFe+HCl->
дMg+Cl2->
е H3PO4 + KOH
Fe⁰ + 2H⁺Cl = Fe⁺²Cl₂ + H₂⁰↑
Fe⁰ -2e -> Fe⁺² | 2 |1 восстановитель - процесс окисления
2H⁺ +1e *2 -> H₂⁰ |2 |1 окислитель - процесс восстановления
-
Mg⁰ + Cl₂⁰ = Mg⁺²Cl₂⁻
Mg⁰ -2e -> Mg⁺² | 2 |1 восстановитель - процесс окисления
2Cl⁺ +1e *2 -> Cl₂⁰ |2 |1 окислитель - процесс восстановления
-
H₃PO₄ + 3KOH = K₃PO₄ + 3H₂O - это реакция ионного обмена, а окислительно-восстановительная.
H⁺ + OH⁻ = H₂O