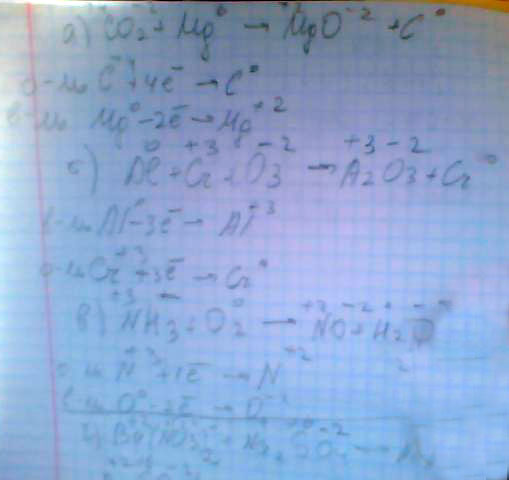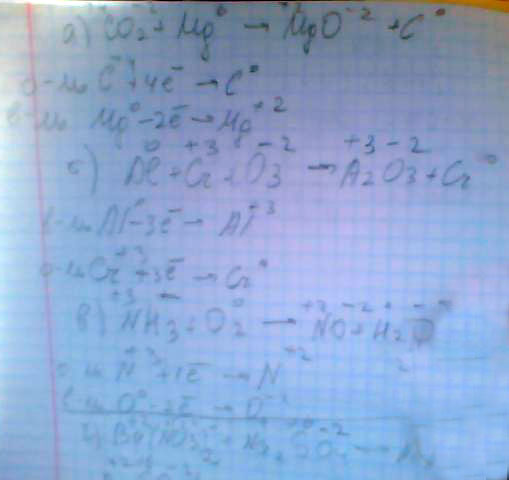Укажите окислитель и восстановитель - задачи и примеры
Расставьте коэффициенты и укажите окислитель и восстановитель в следующих реакциях:
1) Al(NO3)3 → Al2O3 + NO2↑ + O2
2) Zn + H2SO4 конц. → ZnSO4 + S↓ + H2O
3) CrCl3 + KOH + Cl2 → K2CrO4 + KCl + H2O
4Al(N⁺⁵O₃⁻²)₃ = 2Al₂O₃ + 12N⁺⁴O₂ + 3O₂⁰
3N⁺⁵ + 3e⁻ = 3N⁺⁴ | 4 - окислитель, процесс восстановления
2O⁻² - 4e⁻ = O₂⁰ | 3 - восстановитель, процесс окисления
3Zn⁰ + 4H₂S⁺⁶O₄ = 3Zn⁺²SO₄ + S⁰ + 4H₂O
Zn⁰ - 2e⁻ = Zn⁺²| 3 - восстановитель, пр. Окисления
S⁺⁶ + 6e⁻ = S⁰ | 1 - окислитель, пр. Восстановления
2Cr⁺³Cl₃ + 16KOH + 3Cl₂⁰ = 2K₂Cr⁺⁶O₄ + 12KCl⁻ + 8H₂O
Cr⁺³ - 3e⁻ = Cr⁺⁶ | 2 - восстановитель, пр. Окисления
Cl₂⁰ + 2e⁻= 2Cl⁻ | 3 - окислитель, пр. Восстановления
Для окислительно-восстановительной реакции составьте схему электронного баланса, укажите окислитель и восстановитель, процессы окисления и восстановления: Ag2O+Al = Al2O3+Ag
Ag+принимает электрон и становится Ag0
Al0 отдаёт 3 электрона и становится Al3+
Количество отданных и принятых электронов должно быть равно.
Два Ag+ принимают два электрона, а два Al0 отдают 6 электронов. Значит Ag+ должно быть 6.
Уравниваем
3Ag2O +2Al = Al2O3+6Ag
Кто забирает электроны, тот окислитель, но он восстанавливается. Здесь это Ag.
Кто отдаёт электроны, тот восстановитель, но он окисляется. В этом случае Al.
1. Назвать элемент с протонным числом 15. Написать электронную формулу его атома, формулы оксида и кислоты.
2. Определить степени окисления, установить тип химической связи в соединениях, формулы которых:
Cj₂; H₂S; NaI.
3. Закончить уравнения реакций, указать окислитель и восстановитель:
а Mg + HCj → б P + O₂ →
4. Составить электронные уравнения к схемам, указать, какой элемент окисляется, а какой - восстанавливается:
а Cu²⁺ → Cu⁰ б N⁺² → N⁺⁵
5. Щелочной металл I группы имеет гидроксид с относительной молекулярной массой 40. Назвать металл.
1) фосфор, P2O5- высший оксид, H3PO4 2) Cl2(!)- ковалентная неполярная, с. О. 0 H2S- ковалентная полярная с. О. Н- +1 S-2 3) Mg+2HCl(!)= MgCl2+H2 4P+5O2 = 2P2O5 4) CuO+H2= Cu+ H20 Cu-восстанавливается Н- окисляется 5) Na Как решать: I группа => гидр оксид будет иметь вид МеОН Mr OH- 16+1 = 17 40-17 = 23 Mr(Na)= 23
Определить окислитель и восстановитель, расставитьте коэффициенты: Fe2O3+CO-CO2+Fe
1) FeO+CO = Fe+CO2
Fe +2 +2e->Fe 0|2|1|восстановление|окислитель
C +2 -2e->C +4 |2|1|окисление |восстановитель
2)2Fe2O3+C = 4FeO+CO2
Fe +3 + 1e->Fe +2|4|восстановление|окислитель
C 0 -4e->C +4 |1|окисление |восстановитель
Fe2O3+3CO = 3CO2+2Fe
Fe(+3) +3e Fe(0) | 2 |вос-ие
|. |
C(+2) -2e C(+4)| 3 | окис-ие
Fe2O3-окс-ль за счет иона (Fe(+3))
CO-вос-ль
Расставьте коэффициенты в схемах реакций методом электронного баланса. Укажите окислитель и восстановитель, распишите как сделать
а Na+H2 = NaH
бAl+O2 = Al2O3
вCa+N2 = Ca3N2
гFe+HCl = Fecl2+H2
A) 2Na + H2 => 2NaH (добавляем коэффициент 2 так как H было 2 атома и когда мы добавили 2 в полученное уравнение Na появился лишний атом и мы этот атом добавили в левую часть.
б 4Al + 3O2=>2Al2O3 методом креста расставил в правой части ( Al валентность в таблице Менделеева |||, а О ||) в левую часть пишем атомы.
в 3Ca + N2 => Ca3N2 (также как и в б
гFe + 2HCl => FeCl2 + H2
1. Какие из реакций относятся к окислительно-восстановительные?
а CO2+Mg -> MgO+C
бAl +Cr2O3-> Al2O3+Cr
в NH3+O2-> NO+H2O
г Ba (NO3) +Na2SO4-> NaNo3+BaSO4
Для окислительно-восстановительных реакций укажите окислитель и восстановитель, составьте переход электронов