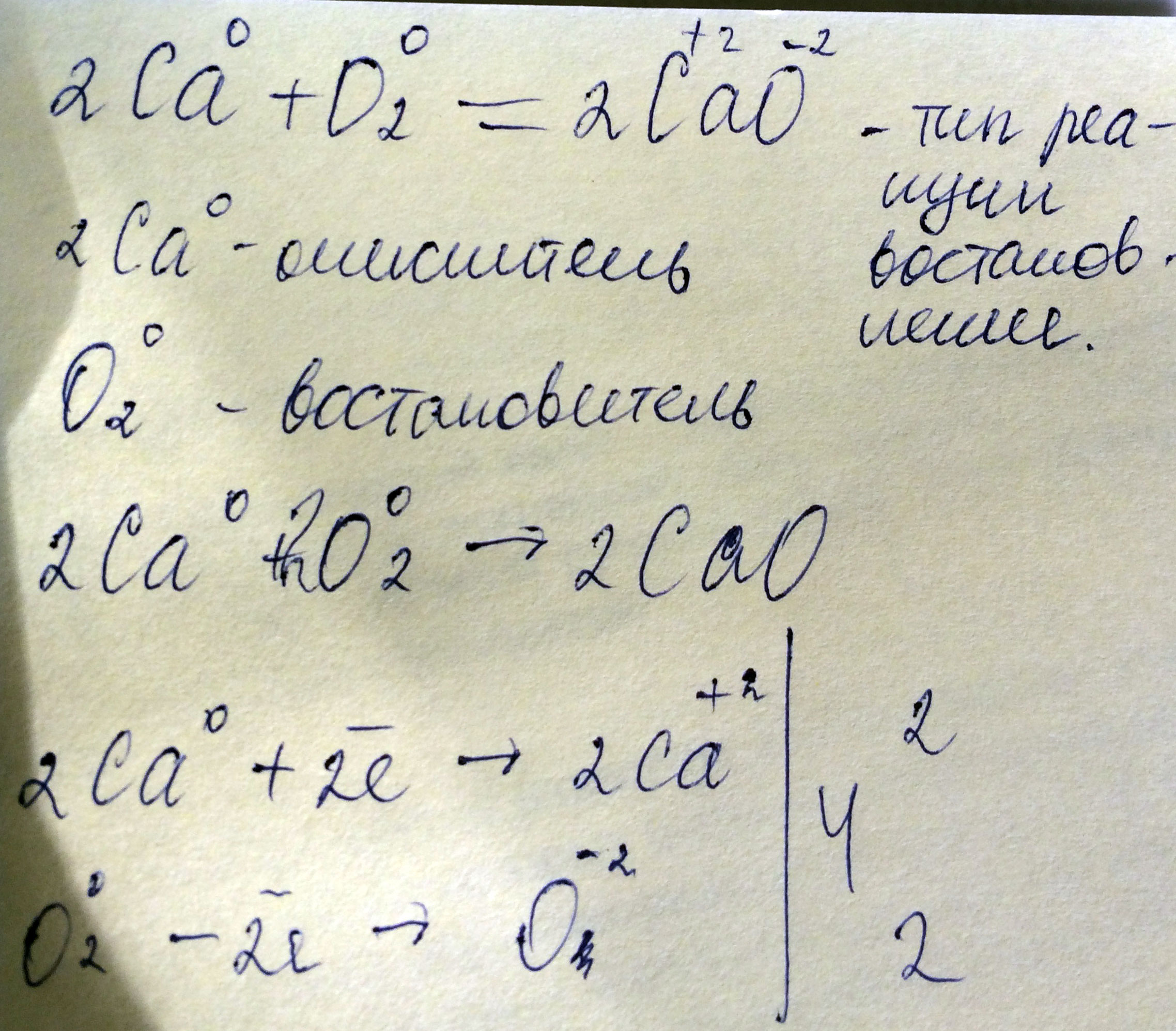Составить электронный баланс - задачи и примеры
Осуществите превращения, напишите молекулярные и ионные уравнения и для 3-его уравнения составьте электронный баланс.
сульфат меди (II) → гидроксид меди (II) → хлорид меди(II)→ медь.
CuSO4 + 2NaOH -> Cu(OH)2 + Na2SO4
Cu(+2) + SO4(-2) + 2Na(+) + 2OH(-) -> Cu(OH)2 + 2Na(+) + SO4(-2)
Cu(+2) + 2OH(-) -> Cu(OH)2
Cu(OH)2 + 2HCl -> CuCl2 + 2H2O
Cu(OH)2 + 2H(+) + 2Cl(-) -> Cu(+2) + 2Cl(-) + 2H2O
Cu(OH)2 + 2H(+) -> Cu(+2) + 2H2O
CuCl2 + Mg -> MgCl2 + Cu
Cu(+2) +2e -> Cu(0) 1 в-ие
ок-ль
Mg(0) -2e -> Mg(+2) 1 ок-ие
в-ль
Реакция ионного обмена: 1) гидроксид калия+сульфат железа(3); 2) карбонат калия +соляная кислота; 3) хлорид меди(2)+нитрат серебра; 4) карбонат кальция+азотная кислота; 5) хлорид бария +нитрат натрия. Электронный баланс: 6) Zn2++2OH-=Zn(OH)2. Окислительно-восстановительно-реакции: 7) CuS+O2 = CuO+SO2; 8) WO3+H2 = W+H2O
1) Fe⁺³SO₄⁻²+2K⁺OH⁻ = K₂⁺SO₄⁻² + Fe⁺³(OH⁻)₃ (осадок
2) K₂⁺CO₃⁻² + 2H⁺Cl⁻ = 2K⁺Cl⁻ + H⁺₂O⁻² + CO₂
3) Cu⁺²Cl₂⁻+2Ag⁺NO₃⁻ = 2Ag⁺Cl⁻+Cu⁺²(NO₃⁻)₂
4) СaCO₃+HNO₃=Ca(NO₃)₂+H₂O+CO₂
5) 2Ba⁺²Cl⁻+2Na⁺No₃⁻ =2Ba⁺²(No₃⁻)₂+ 2Na⁺Cl⁻
Составьте уравнения возможных реакций. Если реакция не протекает, укажите причину.
аMg+fe(NO3)2⇒
бAg+MgCl2⇒
вMg+HCl⇒
гСU+HCl⇒
дMg+H2SO4(разб. )⇒
e) Ba+HOH⇒
жAg+HOH⇒
Для возможных реакчий составьте электронный баланс и ионные уравнения
АMg+fe(NO3)2⇒Fe+Mg(NO3)2
Mg⁰-2e = Mg⁺²
Fe⁺²+2e = Fe°
бAg+MgCl2⇒реакция не идёт магний активнее железа
вMg+2HCl⇒MgCl2+H2
Mg⁰-2e = Mg⁺²
2H⁺+2e = H2
гСU+HCl⇒реакция не идёт медь не вытесняет водород
дMg+H2SO4(разб. )⇒MgSO4+H2
Mg⁰-2e = Mg⁺²
2H⁺+2e = H2
e) Ba+2HOH⇒Ba(OH)2+H2
Ba⁰-2e = Ba⁺²
2H⁺+2e = H2
жAg+HOH⇒реакция не идёт серебро в ряду напряжений стоит после водорода.
Сделать полный и ясный электронный баланс для 2Са+О2 = 2СаО
Нужно подписать, кто восстановитель и окислитель
Напишите электронный баланс к K+H2O
Сначала записываешь уравнения реакций.
K + H20 -> KOH + H2
Затем расставляешь коэффициенты методом электронного баланса.
Для этого выписываешь все элементы, которые изменили свои степени
окисления.
K(0) - e -> K(+) |2|
2H + 2e -> H2(0) |1|
Теперь выписываешь коэффициенты в уравнение.
2K + 2H2O -> 2KOH + H2
И доставляешь недостающие.
Составить электронный баланс, указать окислитель и восстановитель и уравнять реакцию:
а I2 + KOH = KIO3 + KI + H2O
б CuCI + K2Cr2O7 + HCI = CuCI2 + CrCI3 + KCI + H2O
6I2 + 12KOH -> 2KIO3 + 10KI + 6H2O
I2(0) -10e = 2I(+5) 1 в-ль, ок-ие
I2(0) +2e = 2I(-1) 5 ок-ль, в-ие
6СuCl + K2Cr2O7 + 14HCl =6 CuCl2 + 2CrCl3 + 2KCl + 7H2O
Cu(+) -1e = Cu(+2) 6 в-ль, ок-ие
2Cr(+6) + 6e = 2Cr(+3) 1 ок-ль, в-ие
Расставить степени окисления атомов в схемах Ca + HCl → H2 + CaCl2 Fe + Al2O3 → Al + Fe2O3 C + Si→ CSi2 AgNO3→ Ag + NO2↑ + O2↑ Составить схемы переходов электронов/ электронный баланс/
Сa + 2HCl = CaCl2 + H2
Ca(0) + 2H(+) Cl(-) = Ca(+2) Cl(-) + H2(0)
Ca(0) -2e = Ca(+2) 1 в-ль, ок-ие
2H(+) +2e = H2(0) 1 ок-ль, в-ие
2Fe + Al2O3 =2 Al + Fe2O3
Fe(0) + Al(+3) O(-2) = Al(0) + Fe(+3) O(-2)
Fe(0) -3e = Fe(+3) 2 в-ль, ок-ие
2Al(+3) +6e = 2Al(0) 1 ок-ль, в-ие
C + 2Si = CSi2
C(0) + Si(0) = C(+4) Si(-2)
C(0) -4e = C(+4) 1 в-ль, ок-ие
Si(0) +2e = Si(-2) 2 ок-ль, в-ие
2AgNO3 -> 2Ag + 2NO2 + O2
Ag(+) N(+5) O(-2) -> Ag(0) + N(+4) O(-2) + O2(0)
Ag(+)+1e = Ag(0) 2 ок-ль, в-ие
N(+5) +1e = N(+4) 2 ок-ль, в-ие
O(-2) -2e = O(0) 1 в-ль, ок-ие
Составить электронный баланс, указать окислитель и восстановитель, расставить коэффициенты:
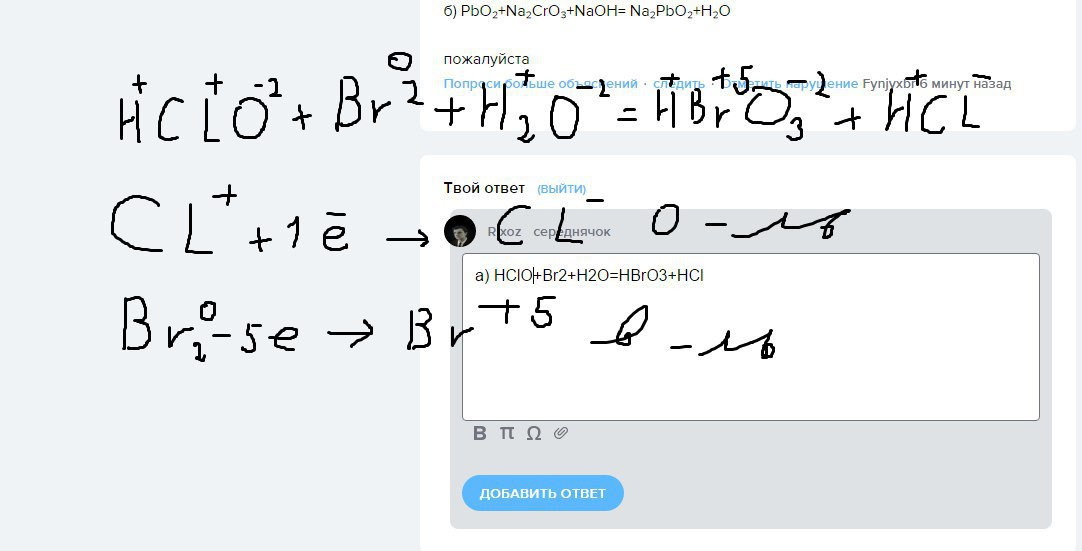
аHClO+Br₂+H₂O = HBrO₃+HCl
б PbO₂+Na₂CrO₃+NaOH= Na₂PbO₂+H₂O
A) HClO+Br₂+H₂O = HBrO₃+HCl
Cl окислитель, Br восстановитель
б PbO₂+Na₂CrO₃+NaOH= Na₂PbO₂+H₂O
2 только эл. баланс, дальше сам sorry(
Определите, к какому типу относиться следующие химические уравнения. Для окислительно-восстановительных реакций составьте электронный баланс. Расставьте коэффициенты в уравнениях реакций.
А3MgO+2H3PO4 = Mg3(PO4)2+3H2O- реакция обмена не ОВР
+1 -1 0 0 +1-2
Б 2HCl+O2 = Cl2+H2O+Q
-1 0
2Cl -2e-Cl2 2 2 восстанов
0 -2 4
O2 +2e*2 2O 4 1 окислитель
0 +4 +2 -2
В С+СO2 = 2CO-Q
0 +2
C-2e -C 2 1 восст.
+4 +2 2
C-+2e-C 2 1 окисл
Г ВаСО3 = ВаО+СО2 реакция разложения не ОВР
Электронный баланс:
SiO2+2C = Si+2CO
Si(4+) +4e = Si(0) | 1
C(0)-2e = C(2+) |2
Si(4+)+2C(0)=Si(0)+2C(2+)
(в скобках указана степень окисления, которую пишут наверху рядом с химическим элементом
Si+4e-4e-Si.|1(окислительно - восстановительная реакция );C+2е-С. |2(восстановительно-окислительная реакция )