Расставить степени окисления атомов в схемах Ca + HCl → H2 + CaCl2 Fe + Al2O3 → Al + Fe2O3 C + Si→ CSi2 AgNO3→ Ag + NO2↑ + O2↑ Составить схемы переходов электронов/ электронный баланс/
Сa + 2HCl = CaCl2 + H2
Ca(0) + 2H(+) Cl(-) = Ca(+2) Cl(-) + H2(0)
Ca(0) -2e = Ca(+2) 1 в-ль, ок-ие
2H(+) +2e = H2(0) 1 ок-ль, в-ие
2Fe + Al2O3 =2 Al + Fe2O3
Fe(0) + Al(+3) O(-2) = Al(0) + Fe(+3) O(-2)
Fe(0) -3e = Fe(+3) 2 в-ль, ок-ие
2Al(+3) +6e = 2Al(0) 1 ок-ль, в-ие
C + 2Si = CSi2
C(0) + Si(0) = C(+4) Si(-2)
C(0) -4e = C(+4) 1 в-ль, ок-ие
Si(0) +2e = Si(-2) 2 ок-ль, в-ие
2AgNO3 -> 2Ag + 2NO2 + O2
Ag(+) N(+5) O(-2) -> Ag(0) + N(+4) O(-2) + O2(0)
Ag(+)+1e = Ag(0) 2 ок-ль, в-ие
N(+5) +1e = N(+4) 2 ок-ль, в-ие
O(-2) -2e = O(0) 1 в-ль, ок-ие
Составить электронный баланс, указать окислитель и восстановитель, расставить коэффициенты:
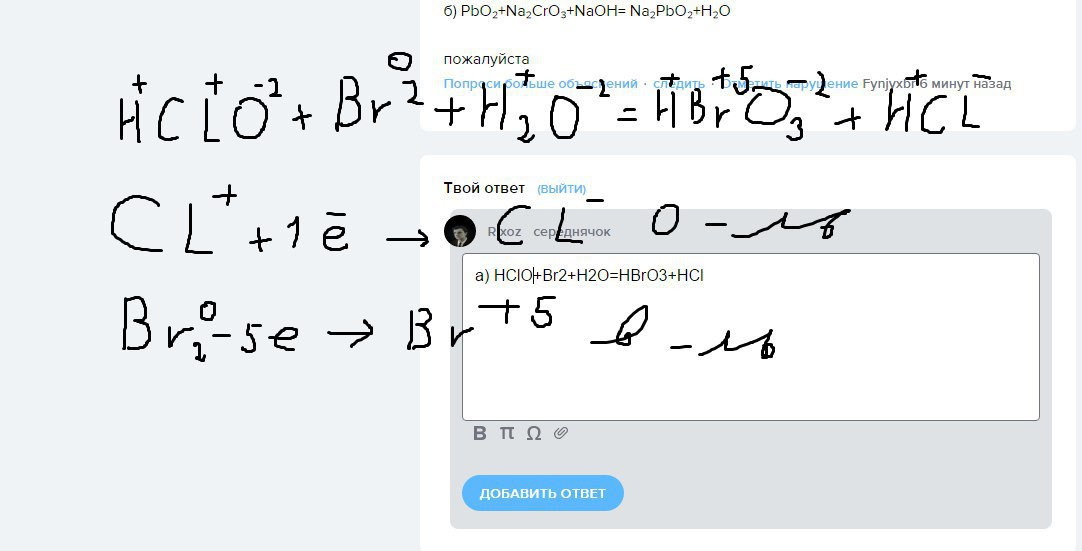
аHClO+Br₂+H₂O = HBrO₃+HCl
б PbO₂+Na₂CrO₃+NaOH= Na₂PbO₂+H₂O
A) HClO+Br₂+H₂O = HBrO₃+HCl
Cl окислитель, Br восстановитель
б PbO₂+Na₂CrO₃+NaOH= Na₂PbO₂+H₂O
2 только эл. баланс, дальше сам sorry(
Определите, к какому типу относиться следующие химические уравнения. Для окислительно-восстановительных реакций составьте электронный баланс. Расставьте коэффициенты в уравнениях реакций.
А3MgO+2H3PO4 = Mg3(PO4)2+3H2O- реакция обмена не ОВР
+1 -1 0 0 +1-2
Б 2HCl+O2 = Cl2+H2O+Q
-1 0
2Cl -2e-Cl2 2 2 восстанов
0 -2 4
O2 +2e*2 2O 4 1 окислитель
0 +4 +2 -2
В С+СO2 = 2CO-Q
0 +2
C-2e -C 2 1 восст.
+4 +2 2
C-+2e-C 2 1 окисл
Г ВаСО3 = ВаО+СО2 реакция разложения не ОВР
Электронный баланс:
SiO2+2C = Si+2CO
Si(4+) +4e = Si(0) | 1
C(0)-2e = C(2+) |2
Si(4+)+2C(0)=Si(0)+2C(2+)
(в скобках указана степень окисления, которую пишут наверху рядом с химическим элементом
Si+4e-4e-Si.|1(окислительно - восстановительная реакция );C+2е-С. |2(восстановительно-окислительная реакция )
H2S+O2 = H2O+S
Составьте электронный баланс, объясняя как это делаете
H2(с. О. +1) S(с. О. 2)+O2(с. О. 0)=S(с. О. +4) O2(с. О. 2)+H2(с. О. +1) O(с. О. 2) заметка: с. О. Это степень окисления S(с. О. 2)-6 электронов = S(с. О. +4)|4 |2 S(с. О. 2)-восстановитель O2(с. О. 0)+4 электрона = 2O(с. О. 2)| 6 |3 O2(с. О. 0)-окислитель значит уравнение будет выглядеть так: 2H2S+3O2 = 2SO2+2H2O
Составьте уравнение реакции, укажите окислитель и восстановитель, приведите электронный баланс:
.Cu+.HNO3=.Cu(NO3)2+.NO2+.H2O
0 +1+5 -2 +2 +4-2
.Cu+.4HNO3=.Cu(NO3)2+.2NO2+.2H2O
0 +2
Сu-2e-Cu 2 1 восстановитель
+5 +4 2
N-+1e-N 1 2 окислитель
