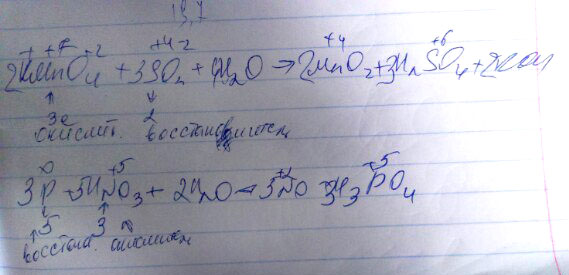Составить электронный баланс - задачи и примеры
KMnO4 + Na2SO3+H2SO4 = MnSO4+K2SO4+Na2SO4+H20
Электронный баланс
MnO4(-) + 8H(+) + 5e = Mn(2+) + 4H2O I 2
SO3(2-) + H2O - 2e = SO4(2-) + 2H(+) I 5
2MnO4(-) + 16H(+) + 5SO3(2-) + 5H2O = 2Mn(2+) + 8H2O + 5SO4(2-) + 10H(+)
2MnO4(-) + 6H(+) + 5SO3(2-) = 2Mn(2+) + 3H2O + 5SO4(2-)
2KMnO4 + 5Na2SO3 + 3H2SO4 = 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
или попроще
Mn(+7) + 5e = Mn(+2) I 2
S(+4) - 2e = S(+6) I 5
отдаёт электроны ( -е ) восстановитель, он окисляется.
принимает электроны ( +е ) окислитель, он восстанавливается.
Разбирите окислительно-востановительные реакции. Составте электронный баланс:
АWO3+AL = W+AL2O3
БK+O2 = K2O
ВFe+Cl2 = FeCl3
А
2Al + WO3 = W + Al2O3
электронный баланс:
Al(0) - 3e = Al(+3) | x2 восстановитель, окисляется
W(+6) + 6e = W(0) | x1 окислитель, восстанавливается.
Б 4K+O2 = 2K2O
K (0) -1e K (+1) | 4 вос-тель окс-ся
O2 (0) +4e 2O (-2) |1 ок-тель, вос-ся
В 2Fe+3Cl2 = 2FeCL3
Fe (0) -3 e Fe (+3) |2 вос-тель, ок-мя
Cl2(0) +2e 2Cl(-1) |3 окс-тель, вос-ся
Электронный баланс: na+h2o => naoh+h2;
pb(no3)2 => 2pbo+no2+o2
2Na + 2H₂O = 2NaOH + H₂
Баланс
$$ \left. \begin{array}{r} \\{2O^{-2}-4e^{-} o O_{2}^{0}}\\{N^{+5}+e^{-} o N^{+4}} \end{array}\right|4 \left| \begin{array}{l} \\{1-reducing;agent}\\{4-oxidizing;agent} \end{array}\right. $$.
Составьте электронный баланс к реакции 2No + H2O + SO2 = N2O + H2SO4
2NO + H2O + SO2 = N2O + H2SO4
Степени окисления меняет азот и сера. Составляем баланс
$$ \left. \begin{array}{r} \mathrm{S^{+4}-2e^{-} o S^{+6}} \mathrm{N^{+2}+e^{-} o N^{+}} \end{array}\right|2 \left| \begin{array}{l} \mathrm{1-reducing;agent} \mathrm{2-oxidizing;agent} \end{array}\right. $$
Электронный баланс составить, указав окислители и восстановители. 1. KMnO4+SO2+H2O = MnO2+H2SO4+KOH
2. P+HNO3+H2O = NO+H3PO4
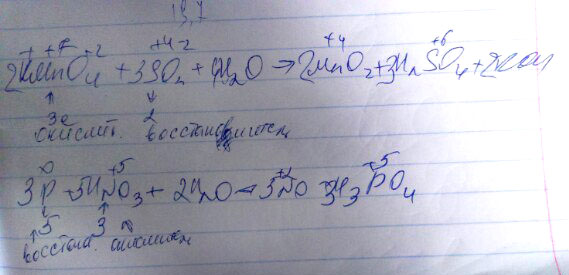
Составить электронный баланс и указать окислитель и восстановитель в реакции.
,
4N⁻³H₃+5O₂⁰= 4N⁺²O⁻²+6H₂O
N³⁻ - 5e⁻ = N²⁺ | 4 восстановитель, процесс окисления
O₂⁰ +4e⁻ =2O²⁻ | 5 окислитель, процесс восстановления
2Mn₂⁺³O₃ + 3Si⁰ = 3Si⁺⁴O₂ + 4Mn⁰
Mn⁺³ +3e⁻ = Mn⁰ | 4 окислитель, процесс восстановления
Si⁰ - 4e⁻ = Si⁴⁺ | 3 восстановитель, процесс окисления
Сl₂⁰ + H₂⁰ = 2H⁺Cl⁻
Cl₂⁰+2e⁻ = 2Cl⁻ | 1 окислитель, процесс восстановления
H₂⁰-2e⁻ = 2H⁻ | 1 восстановитель, процесс окисления
P₂⁺⁵O₅+5C⁰ = 2P⁰+5C⁺²O
P⁵⁺+5e⁻ = P⁰ | 2 окислитель, процесс восстановления
C⁰ -2e⁻ = C²⁺ | 5 восстановитель, процесс окисления
N₂⁰+3H₂⁰ = 2N⁻³H₃⁺
N₂⁰+6e⁻ = 2N³⁻ | 1 окислитель, процесс восстановления
H₂⁰-2e⁻ = 2H⁺ | 3 восстановитель, процесс окисления
2KCl⁺⁵O₃ + 3S⁰= 2KCl⁻ + 3S⁺⁴O₂
Cl⁵⁺ + 6e⁻ = Cl⁻ | 2 окислитель, процесс восстановления
S⁰ - 4e⁻ = S⁴⁺ | 3 восстановитель, процесс окисления